Tailieumoi.vn xin giới thiệu Bài tập Hoá học 9 :Bài tập tổng hợp về axit axetic. Bài viết gồm 50 bài tập với đầy đủ các mức độ và có hướng dẫn giải chi tiết sẽ giúp học sinh ôn luyện kiến thức và rèn luyện kĩ năng làm bài tập Hoá học 9. Ngoài ra, bài viết còn có phần tóm tắt nội dung chính lý thuyết Bài tập tổng hợp về axit axetic. Mời các bạn đón xem:
Bài tập Hoá học 9: Bài tập tổng hợp về Axit axetic
A. Bài tập tổng hợp về axit axetic
I. Ví dụ minh họa
Ví dụ 1: Công thức cấu tạo của axit axetic (C2H4O2) là
A. O = CH – O – CH3
D. CH2 – O – O – CH2
Hướng dẫn giải:
Công thức cấu tạo của axit axetic là
Đáp án B
Ví dụ 2: Hòa tan hoàn toàn 6,5 gam Zn vào dung dịch CH3COOH. Thể tích khí H2 thoát ra (đktc) là
A. 0,56 lít
B. 1,12 lít
C. 2,24 lít
D. 3,36 lít
Hướng dẫn giải:
0,1 0,1 mol
Thể tích hiđro là 0,1.22,4 = 2,24 lít
Đáp án C
Ví dụ 3: Trung hòa 400 ml dung dịch axit axetic 0,5M bằng dung dịch NaOH 0,5M. Thể tích dung dịch NaOH cần dùng là
A. 100 ml
B. 200 ml
C. 300 ml
D. 400 ml
Hướng dẫn giải:
0,2 0,2 mol
VNaOH = 0,2 : 0,5 = 0,4 lít =400ml
Đáp án D
II. Bài tập vận dụng
Câu 1: Ứng dụng nào sau đây không phải của axit axetic?
A. Pha giấm ăn
B. Sản xuất dược phẩm, phẩm nhuộm, thuốc diệt côn trùng
C. Sản xuất cồn
D. Sản xuất chất dẻo, tơ nhân tạo
Hướng dẫn giải:
Một số ứng dụng của axit axetic là sản xuất tơ nhân tạo, chất dẻo, dược phẩm, phẩm nhuộm hay sản xuất giấm ăn,..
Đáp án C
Câu 2: Dãy chất phản ứng với axit axetic là
A. ZnO, Cu, Na2CO3, KOH
B. ZnO, Fe, Na2CO3, Ag
C. SO2, Na2CO3, Fe, KOH
D. ZnO, Na2CO3, Fe, KOH
Hướng dẫn giải:
Axit axetic là axit yếu nên không phản ứng với kim loại yếu, đứng sau H trong dãy hoạt động. Loại A, B
Axit axetic không phản ứng với oxit axit SO2. Loại C
Đáp án D
Câu 3: Tính chất vật lý của axit axetic là
A. Chất lỏng, không màu, vị chua, tan vô hạn trong nước
B. Chất lỏng, màu trắng, vị chua, tan vô hạn trong nước
C. Chất lỏng, không màu, vị đắng, tan vô hạn trong nước
D. Chất lỏng, không màu, vị chua, không tan trong nước
Hương dẫn giải:
Axit axetic là chất lỏng, khôn màu, vị chua, tan vô hạn trong nước.
Đáp án A
Câu 4: Giấm ăn là dung dịch axit axetic có nồng độ từ
A. 2% đến 5%
B. 6% đến 10%
C. 11% đến 14%
D. 15% đến 18%
Hướng dẫn giải:
Giấm ăn là axit axetic có nồng độ tử 2% đến 5%.
Đáp án A
Câu 5: Phản ứng giữa axit axetic với dung dịch bazơ thuộc loại
A. Phản ứng oxi hóa - khử
B. Phản ứng hóa hợp
C. Phản ứng phân hủy
D. Phản ứng trung hòa
Hướng dẫn giải:
Axit axetic là một axit hữu cơ. Nên phản ứng giữa axit và bazo là phản ứng trung hòa.
Đáp án D
Câu 6: Axit axetic tác dụng với kẽm giải phóng khí
A. hiđro (H2)
B. hiđro clorua (HCl)
C. hiđro sunfua (H2S)
D. amoniac (NH3)
Hướng dẫn giải:
Đáp án A
Câu 7: Phương trình phản ứng sản xuất axit axetic trong công nghiệp là:
C4H10 + O2 CH3COOH + H2O
Tổng hệ số trong phương trình phản ứng trên là
A. 11
B. 12
C. 13
D. 14
Hướng dẫn giải:
Đáp án C
Câu 8: Cho 100 ml dung dịch CH3COOH 0,1M vào 100 ml dung dịch Ca(OH)2 0,1M. Dung dịch sau phản ứng có khả năng:
A. Làm quỳ tím hóa xanh
B. Làm quỳ tím hóa đỏ
C. Không làm quỳ tím đổi màu
D. Tác dụng với Mg giải phóng khí H2
Hướng dẫn giải:
Ban đầu 0,01 0,01
Phản ứng 0,01 0,005
Sau phản ứng 0 0,005
Dung dịch sau phản ứng gồm Ca(OH)2,
Dung dịch sau phản ứng là quỳ tím hóa xanh
Đáp án A
Câu 9: Cho dung dịch chứa 10 gam CH3COOH tác dụng với dung dịch chứa 10 gam KOH. Sau khi phản ứng hoàn toàn dung dịch chứa các chất tan là:
A. CH3COOK và KOH
B. CH3COOK và CH3COOH
C. CH3COOK
D. CH3COOK, CH3COOH và KOH
Hướng dẫn giải:
Ban đầu 0,167 0,179
Phản ứng 0,167 0,167
Sau phản ứng 0 0,012
Dung dịch sau phản ứng gồm KOH, CH3COOK
Đáp án A
Câu 10: Cho axit axetic có nồng độ x% tác dụng vừa đủ với dung dịch NaOH có nồng độ 10% thì thu được dung dịch muối có nồng độ 10,25%. Vậy x có giá trị là:
A. 20%
B. 16%
C. 17%
D. 15%
Hướng dẫn giải:
1 1 mol
Mặt khác:
Đáp án D
Câu 11: Chia a gam axit axetic thành 2 phần bằng nhau:
-Phần 1: Trung hòa vừa đủ bởi 0,5 lít dung dịch NaOH 0,4 M
-Phần 2: Thực hiện phản ứng este hóa với ancol etylic thu được m gam este (giả sử hiệu suất phản ứng là 100%)
Vậy m có giá trị là:
A. 16,7 gam
B. 17,6 gam
C. 16,8 gam
D. 18,6 gam
Hướng dẫn giải:
Mà hiệu suất là 100% nên neste =
meste = 0,2.88=17,6 g
Đáp án B
Câu 12: Cho 150 gam axit axetic tác dụng với 161 gam ancol etylic có H2SO4 đặc làm xúc tác. Khi phản ứng xảy ra xong thì có 60% lượng axit chuyển thành este. Khối lượng este thu được sau khi phản ứng kết thúc là:
A. 132 gam
B. 230 gam
C. 235 gam
D. 240 gam
Hướng dẫn giải:
Ban đầu 2,5 3,5 mol
Phản ứng 2,5 2,5 2,5
Do hiệu suất là 60% nên số mol este là 2,5.60% = 1,5 mol
Khối lượng của este là 1,5.88= 132 g
Đáp án A
Câu 13: Cho 12 gam axit axetic tác dụng với 9,2 gam rượu etylic đun nóng và có mặt H2SO4 đặc làm xúc tác (hiệu suất 100%) khối lượng etyl axetat là:
A. 8,8 g
B. 88 g
C. 17,6 g
D. 176 g
Hướng dẫn giải:
Ban đầu 0,2 0,2 mol
Suy ra khối lượng este thu được là 0,2.88 = 17,6 g
Đáp án C
Câu 14: Hòa tan hoàn toàn 24 gam CuO vào dung dịch CH3COOH 10% . Khối lượng dung dịch CH3COOH cần dùng là:
A. 360 gam
B. 380 gam
C. 340 gam
D. 320 gam
Hướng dẫn giải:
0,3 0,6 mol
Đáp án A
Câu 15: Cho 20,5 gam hỗn hợp ancol etylic và axit axetic tác dụng với kali dư thu được 4,48 lít H2 (đktc). Nếu cho hỗn hợp đó thực hiện phản ứng este hóa thì khối lượng este thu được là bao nhiêu? Biết H= 100%
A. 10 gam
B. 12 gam
C. 13,2 gam
D. 14,2 gam
Hướng dẫn giải:
Gọi số mol của ancol và axit lần lượt là x, y mol
x 0,5x mol
y 0,5y mol
Ta có hệ phương trình:
Phản ứng este hóa:
Ban đầu 0,15 0,25 mol
Phản ứng 0,15 0,15 0,15 mol
Khối lượng este là 0,15.88= 13,2 g
Đáp án C
Câu 16: Cho 100 gam dung dịch CH3COOH 12% tác dụng vừa đủ với dung dịch NaHCO3 8,4%. Nồng độ phần trăm của dung dịch muối thu đươc sau phản ứng là
A. 8,63%.
B. 7,63%.
C. 6,63%.
D. 5,63%.
Hướng dẫn giải:
Đáp án D
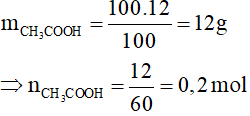
Phương trình hóa học:
CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O
0,2……………0,2…………….0,2………0,2 mol
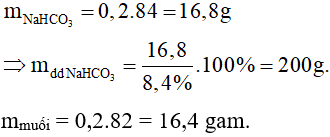
Khối lượng dd sau phản ứng là:
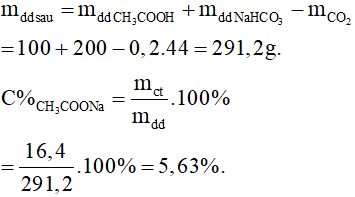
Câu 17: Dung dịch X chứa HCl và CH3COOH. Để trung hòa 100ml dung dịch X cần dùng 30ml dung dịch NaOH 1M. Cô cạn dung dịch đã trung hòa thì được 2,225 gam muối khan. Nồng độ mol của CH3COOH trong X là
A. 0,1M.
B. 0,2M.
C. 0,3M.
D. 0,4M.
Hướng dẫn giải:
Đáp án B
Gọi a và b lần lượt là số mol của HCl và CH3COOH có trong 100ml X.
Phương trình hóa học:
HCl + NaOH → NaCl + H2O
a…….a………….a mol
CH3COOH + NaOH → CH3COONa + H2O
b……………….b………….b mol
Theo bài ra:
nNaOH = 0,03.1 = a + b (1)
mmuối = 58,5a + 82b = 2,225 (2)
Từ (1) và (2) có a = 0,01 và b = 0,02 mol
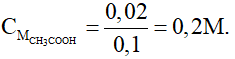
Câu 18: Cho dung dịch axit axetic nồng độ a% tác dụng vừa đủ với dung dịch NaOH 10% thu được dung dịch muối có nồng độ 10,25%. Tính nồng độ của axit axetic đem dùng.
A. 12%.
B. 13%.
C. 14%.
D. 15%.
Hướng dẫn giải:
Đáp án D
Gọi khối lượng của dung dịch CH3COOH và NaOH lần lượt là x và y gam.
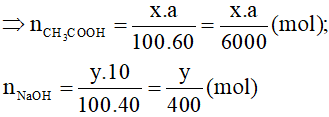
Phương trình hóa học:
CH3COOH + NaOH → CH3COONa + H2O
Do phản ứng là vừa đủ:
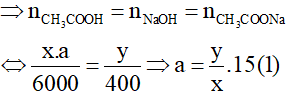
Lại có:
C%muối = 10,25%
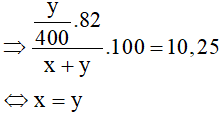
Thay x = y vào (1) được a = 15. Vậy nống độ CH3COOH đem dùng là 15%.
B. Lý thuyết Bài tập tổng hợp về rượu Etylic
Để làm tốt các bài tập về axit axetic, học sinh cần nắm vững các tính chất hóa học của axit axetic như sau:
1. Axit axetic có tính chất của một axit
- Làm đổi màu quỳ tím sang màu đỏ.
- Tác dụng với kim loại (trước H) giải phóng H2
Ví dụ:
2CH3COOH + 2Na → 2CH3COONa + H2
2CH3COOH + Mg → (CH3COO)2Mg + H2
+ Tác dụng với bazơ → muối và nước
Ví dụ:
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + Ba(OH)2 → (CH3COO)2Ba + 2H2O
+ Tác dụng với oxit bazơ → muối và nước
Ví dụ:
2CH3COOH + CaO → (CH3COO)2Ca + H2O
+ Tác dụng với muối của axit yếu hơn
Ví dụ:
2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O.
Chú ý: Axit axetic là axit yếu.
2. Tác dụng với rượu etylic tạo ra este và nước
Phương trình hóa học:
CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O.
Este thu được là etylaxetat là chất lỏng, mùi thơm, ít tan trong nước, dùng làm dung môi trong công nghiệp.