Tailieumoi.vn xin giới thiệu Bài tập Hoá học 9 :Bài tập tổng hợp về rượu Etylic. Bài viết gồm 50 bài tập với đầy đủ các mức độ và có hướng dẫn giải chi tiết sẽ giúp học sinh ôn luyện kiến thức và rèn luyện kĩ năng làm bài tập Hoá học 9. Ngoài ra, bài viết còn có phần tóm tắt nội dung chính lý thuyết Bài tập tổng hợp về rượu Etylic. Mời các bạn đón xem:
Bài tập Hoá học 9: Bài tập tổng hợp về rượu Etylic
A. Bài tập tổng hợp về rượu Etylic
I. Ví dụ minh họa
Ví dụ 1: Ancol etylic cháy theo sơ đồ phản ứng:
C2H6O + O2 → CO2 + H2O
Hệ số cân bằng của phương trình lần lượt là:
A. 2, 3, 4, 5
B. 2, 3, 2, 3
C. 1, 3, 2, 3
D. 1, 3, 3, 3
Hướng dẫn giải:
C2H6O + 3O2 2CO2 + 3H2O
Đáp án C
Ví dụ 2: Đun nóng axit axetic với rượu etylic có axit sunfuric làm xúc tác thì người ta thu được một chất lỏng không màu, mùi thơm, không tan trong nước và nổi trên mặt nước. Sản phẩm đó là
A. đimetyl ete
B. etyl axetat
C. rượu etylic
D. metan
Hướng dẫn giải:
Etyl axetat
Đáp án B
Ví dụ 3: Để đốt cháy hoàn toàn 0,1 mol ancol có công thức CnH2n+1OH thì cần 10,08 lít khí oxi (đktc). CTPT của ancol là:
A. CH3OH
B. C2H5OH
C. C3H7OH
D. C4H9OH
Hướng dẫn giải:
noxi = 0,45 mol
0,1 0,45 mol
Theo phương trình hóa học ta có:
Đáp án C
II. Bài tập vận dụng
Câu 1: Từ ancol etylic người ta có thể điều chế được sản phẩm nào sau đây?
A. Axit axetic
B. Cao su tổng hợp
C. Etyl axetat
D. Cả ba đáp án trên đều đúng
Hướng dẫn giải:
Người ta dùng ancol etylic để sản xuất rượu bia, dược phẩm, cao su tổng hợp, axit axetic hoặc các este.
Đáp án D
Câu 2: Ancol etylic có lẫn một ít nước, có thể dùng chất nào sau đây để làm khan ancol etylic?
A. NaOH
B. H2SO4 đặc
C. CuSO4 khan
D. Cả ba đáp án trên
Hướng dẫn giải:
Để làm khan ancol etylic người ta dùng CuSO4 khan.
Đáp án C
Câu 3: Ancol etylic được điều chế từ nguồn nào sau đây?
A. Tinh bột
B. Glucozơ
C. Etilen
D. Cả ba đáp án trên
Hướng dẫn giải:
Ancol etylic được điều chế tử tinh bột, glucozơ hoặc etilen.
Đáp án D
Câu 4: Ancol etylic có khả năng tan tốt trong nước là do:
A. Ancol etylic tạo được liên kết hidro với nước
B. Ancol etylic uống được
C. Ancol etylic là chất lỏng
D. Ancol etylic chứa cacbon và hidro
Hướng dẫn giải:
Ancol etylic tan tốt trong nước do tạo được liên kết hiđro với nước.
Đáp án A
Câu 5: Ancol etylic phản ứng được với natri vì?
A. Trong phân tử có nguyên tử oxi
B. Trong phân tử có nguyên tử hidro và nguyên tử oxi
C. Trong phân tử có nguyên tử cacbon, hidro và oxi
D. Trong phân tử có nhóm –OH
Hướng dẫn giải:
Ancol etylic có khả năng tác dụng với natri vì trong phân tử có nhóm –OH.
Đáp án D
Câu 6: Độ rượu là
A. Số mol rượu etylic có trong 100 ml hỗn hợp rượu với nước
B. Số ml rượu etylic có trong 1000 ml hỗn hợp rượu với nước
C. Số lít rượu etylic có trong 100 ml hỗn hợp rượu với nước
D. Số ml rượu etylic có trong 100 ml hỗn hợp rượu với nước
Hướng dẫn giải:
Độ rượu là số ml rượu etylic có trong 100 ml hỗn hợp rượu với nước.
Đáp án D
Câu 7: Công thức cấu tạo thu gọn của rượu etylic là:
A. CH3 – CH2 – OH
B. CH3 – O – CH3
C. CH3OH
D. CH3 – O – C2H5
Hướng dẫn giải:
Công thức cấu tạo của rượu etylic là CH3 – CH2 – OH.
Đáp án A
Câu 8: Số mol rượu etylic có trong 200 ml rượu C2H5OH 46o (D= 0,8 g/ml)?
A. 0,4 mol
B. 0,8 mol
C. 1,6 mol
D. 3,2 mol
Hướng dẫn giải:
Vrượu nguyên chất = ml
Suy ra m= D.V= 92.0,8= 73,6 g
nrượu = 1,6 mol
Đáp án C
Câu 9: Nhiệt độ sôi của rượu etylic là
A. 78,30C
B. 87,30C
C. 73,80C
D. 83,70C
Hướng dẫn giải:
Nhiệt độ sôi của rượu etylic là 78,30C.
Đáp án A
Câu 10: Rượu etylic cháy trong không khí, hiện tượng quan sát được là
A. Ngọn lửa màu đỏ, tỏa nhiều nhiệt
B. Ngọn lửa màu vàng, tỏa nhiều nhiệt
C. Ngọn lửa màu xanh, tỏa nhiều nhiệt
D. Ngọn lửa màu xanh, không tỏa nhiệt
Hướng dẫn giải:
Khi rượu etylic cháy trong không khí cho ngọn lửa màu xanh và tỏa nhiều nhiệt.
Đáp án C
Câu 11: Số ml rượu etylic có trong 500 ml rượu 400 là:
A. 20ml
B. 200ml
C. 2ml
D. 0,2ml
Hướng dẫn giải:
Gọi số ml rượu nguyên chất là x
Đáp án B
Câu 12: Rượu etylic trong phân tử gồm
A. Nhóm etyl (C2H5) liên kết với nhóm – OH
B. Nhóm metyl (CH3) liên kết với nhóm – OH
C. Nhóm hyđrocacbon liên kết với nhóm – OH
D. Nhóm metyl (CH3) liên kết với oxi
Hướng dẫn giải:
Rượu etylic có nhóm etyl liên kết với nhóm –OH.
Đáp án A
Câu 13: Cho một mẫu natri vào ống nghiệm đựng rượu etylic. Hiện tượng quan sát được là
A. Có bọt khí màu nâu thoát ra
B. Mẫu natri tan dần không có bọt khí thoát ra
C. Mẫu natri nằm dưới bề mặt chất lỏng và không tan
D. Có bọt khí không màu thoát ra và natri tan dần
Hướng dẫn giải:
Khi cho natri vào rượu etylic có hiện tượng mẩu natri tan dần và bọt khí thoát ra.
Đáp án D
Câu 14: Để phân biệt hai chất lỏng không màu là benzen và rượu etylic ta dùng
A. Fe
B. Cu
C. Na
D. Zn
Hướng dẫn giải:
Để phân biệt 2 chất trên ta dùng kim loại natri.
Benzen không tác dụng với natri còn rượu etylic tác dụng với natri và sinh ra khí H2.
Đáp án C
Câu 15: Cho 11,2 lít khí etilen (đktc) tác dụng với nước có axit sunfuric (H2SO4) làm xúc tác, thu được 9,2 gam rượu etylic. Hiệu suất phản ứng là
A. 40%
B. 45%
C. 50%
D. 55%
Hướng dẫn giải:
0,4 ………………0,4 mol
Hiệu suất phản ứng là
Đáp án C
Câu 16: Cho 360 gam glucozơ lên men thành rượu etylic. Cho tất cả khí CO2 sinh ra hấp thụ hoàn toàn vào 2 lít dung dịch NaOH 1M thì thu được 137 gam muối. Hiệu suất của phản ứng lên men rượu là
A. 37,5%
B. 50%
C. 75%
D. 80%
Hướng dẫn giải:
nglucozơ = 360:180= 2 mol; nNaOH = 2 mol
2 4 mol
CO2 tác dụng với dung dịch kiềm tạo 2 muối là NaHCO3 a (mol) và Na2CO3 b (mol)
Ta có hệ phương trình:
Bảo toàn nguyên tố C ta có:
Hiệu suất phản ứng là:
Đáp án A
Câu 17: Lên men dung dịch chứa 300 gam glucozơ thu được 92 gam ancol etylic. Hiệu suất quá trình lên men tạo thành ancol etylic là
A. 50%
B. 60%
C. 70%
D. 80%
Hướng dẫn giải:
Phương trình phản ứng:
1 2 mol
Hiệu suất của phản ứng là:
Đáp án B
Câu 18: Hòa tan 84 gam ancol etylic vào nước để được 300 ml dung dịch ancol. Biết Dancol = 0,8 g/cm3, Dnước = 1g/cm3 và thể tích không khí không hao hụt khi pha trộn. Nồng độ phần trăm và độ rượu của dung dịch thu được là:
A. 30,11% và 35o
B. 35,11% và 35o
C. 40,11% và 30o
D. 45,11% và 40o
Hướng dẫn giải:
mdd =
C%=
Độ rượu là o
Đáp án A
Câu 19: Lên men dung dịch glucozơ thu được ancol etylic và khí CO2. Dẫn khí CO2 thu được vào dung dịch nước vôi trong thu được 80 g kết tủa. Biết hiệu suất của phản ứng là 80%.Tính lượng glucozơ ban đầu?
A. 36 g
B. 45 g
C. 78 g
D. 90 g
Hướng dẫn giải:
Bảo toàn nguyên tố C:
0,4 0,8 mol
Đáp án D
Câu 20: Cho 13,6 gam hỗn hợp X gồm axit axetic và rượu etylic được trộn theo tỉ lệ mol tương ứng là 3 : 2. Đun nóng X với H2SO4 đặc một thời gian thu được m gam este CH3COOCH2CH3 với hiệu suất phản ứng là 90%. Giá trị của m là
A. 7,04g B. 8,80g C. 7,92g D. 11,00g ![]()
Hướng dẫn giải
Đáp án C
Gọi số mol của CH3COOH là 3a mol → số mol của CH3CH2OH là 2a mol
mX = 13,6 gam → 60.3a + 46.2a = 13,6 → a = 0,05 mol
PTHH:
CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O
0,15 0,1 mol
Giả sử hiệu suất là 100% thì rượu etylic hết, nên số mol sản phẩm phản ứng tính theo số mol rượu etylic.
Số mol este là: neste thực tế = neste lý thuyết. H = 0,1.90% = 0,09 mol
→ m = n.M = 0,09.88 = 7,92 gam
Câu 21: Đốt cháy hoàn toàn 50ml rượu etylic a độ thu được 22,4 lít khí CO2 ở đktc. (Biết khối lượng riêng của rượu là 0,8g/ml). Giá trị của a là
A. 57,5.
B. 60.
C. 62.
D. 70.
Hướng dẫn giải
Đáp án A
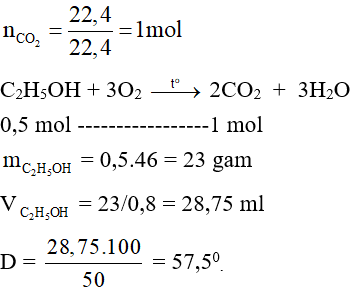
Câu 22: Cho 30 gam axit axetic tác dụng với rượu etylic dư tạo ra 27,5 gam etyl axetat. Hiệu suất của phản ứng là
A. 72,5%.
B. 62,5 %.
C. 56,2%.
D. 65,2 %.
Hướng dẫn giải
Đáp án B
Ta có:
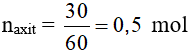
PTHH: CH3COOH + CH3CH2OH  CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
0,5 → 0,5 mol
Lượng este tạo ra theo lý thuyết là: meste (LT) = 0,5.88 = 44 gam.
Hiệu suất phản ứng là:
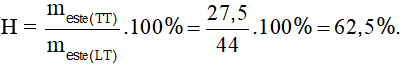
Câu 23: Cho 18 gam một rượu X, thuộc cùng dãy đồng đẳng với rượu etylic (có công thức tổng quát CnH2n+1OH) tác dụng với một lượng dư kim loại Na thu được 3,36 dm3 khí H2 ở đktc. Công thức hóa học của rượu X là
A. CH3OH.
B. C2H5OH.
C. C3H7OH.
D. C4H9OH.
Hướng dẫn giải
Đáp án C
Đổi 3,36 dm3 = 3,36 lít
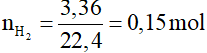
Phương trình hóa học:
2CnH2n+1OH + 2Na → 2CnH2n+1ONa + H2
0,3……………………………………..0,15 mol
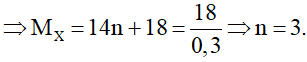
Vậy công thức hóa học của X là C3H7OH.
B. Lý thuyết Bài tập tổng hợp về rượu Etylic
Để làm được các bài tập liên quan đến rượu etylic, học sinh cần nắm được các phản ứng hóa học của rượu như sau:
a) Phản ứng cháy
Rượu etylic cháy với ngọn lửa màu xanh, tỏa nhiều nhiệt.
C2H6O + 3O2 2CO2 + 3H2O
b) Tác dụng với kim loại mạnh như K, Na,... giải phóng khí H2
Ví dụ:
2CH3 – CH2 – OH + 2Na → 2CH3 – CH2 – ONa + H2.
c) Tác dụng với axit axetic
Rượu etylic tác dụng với axit axetic thu được este.
Phương trình hóa học:
CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O.
axit axetic rượu etylic etylaxetat
Ngoài ra, học sinh cần nắm được kiến thức về độ rượu:
Độ rượu là số ml rượu etylic có trong 100 ml hỗn hợp rượu với nước
|
Độ rượu = |
Trong đó: Vr là thể tích rượu nguyên chất.