Với tóm tắt lý thuyết Hóa học lớp 9 Các oxit của cacbon hay, chi tiết cùng với 20 câu hỏi trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học lớp 9.
Hóa học 9 Bài 28: Các oxit của cacbon
A. Lý thuyết Các oxit của cacbon
1. Tính chất vật lí
CO là chất khí, không màu, không mùi, hơi nhẹ hơn không khí 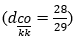
2. Tính chất hóa học
a) CO là oxit trung tính
Ở điều kiện thường không phản ứng với nước, kiềm và axit.
b) CO là chất khử
- Ở nhiệt độ cao, cacbon oxit khử được nhiều oxit kim loại
Ví dụ:
- CO cháy trong oxi hoặc trong không khí với ngọn lửa màu xanh, tỏa nhiều nhiệt.
Phương trình hóa học:
3. Ứng dụng
Khí CO được dùng làm nhiên liệu, chất khử… trong công nghiệp. Ngoài ra còn được dùng làm nguyên liệu trong công nghiệp hóa học.
1. Tính chất vật lí
CO2 là chất khí, không màu, không mùi, nặng hơn không khí 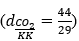
CO2 bị nén và làm lạnh thì hóa rắn được gọi là nước đá khô (tuyết cacbonic). Nước đá khô được dùng để bảo quản thực phẩm.
2. Tính chất hóa học: CO2 là một oxit axit.
a) Tác dụng với nước tạo thành axit cacbonic
Phương trình hóa học:
CO2 + H2O ⇄ H2CO3
Chú ý: CO2 phản ứng với nước tạo thành dung dịch axit, làm quỳ tím chuyển sang màu đỏ. H2CO3 không bền, dễ phân hủy thành CO2 và nước, khi đun nóng dung dịch thu được sẽ lại làm quỳ màu đỏ chuyển sang màu tím.
b) Tác dụng với dung dịch bazơ
Khí CO2 tác dụng với dung dịch bazơ tạo thành muối và nước. Tùy theo tỉ lệ số mol giữa CO2 và dung dịch bazơ mà có thể tạo ra muối trung hòa, muối axit hay hỗn hợp hai muối.
Ví dụ:
c) Tác dụng với oxit bazơ
CO2 tác dụng với oxit bazơ (tan) tạo thành muối.
Ví dụ:
3. Ứng dụng
CO2 được dùng để chữa cháy, bảo quản thực phẩm.
Ngoài ra, CO2 còn được dùng trong sản xuất nước giải khát có gas, sản xuất sođa, phân đạm,...
B. Trắc nghiệm Các oxit của cacbon
Bài 1: “Nước đá khô“ không nóng chảy mà thăng hoa nên được dùng để tạo môi trường lạnh và khô rất tiện cho việc bảo quản thực phẩm. Nước đá khô là
A. CO rắn. B. SO2 rắn.
C. H2O rắn. D. CO2 rắn.
Lời giải
Nước đá khô là CO2 rắn
Đáp án: D
Bài 2: Hiệu ứng nhà kính là hiện tượng Trái đất đang ấm dần lên, do các bức xạ có bước sóng dài trong vùng hồng ngoại bị giữ lại, mà không bức xạ ra ngoài vũ trụ. Chất khí nào sau đây là nguyên nhân gây ra hiệu ứng nhà kính?
A. H2. B. N2.
C. CO2. D. O2.
Lời giải
Chất khí gây ra hiệu ứng nhà kính là CO2
Đáp án: C
Bài 3: Khí CO2 điều chế trong phòng TN thường lẫn khí HCl và hơi nước. Để loại bỏ HCl và hơi nước ra khỏi hỗn hợp, ta dùng
A. Dung dịch NaOH đặc.
B. Dung dịch Na2CO3 bão hoà và dung dịch H2SO4 đặc.
C. Dung dịch H2SO4 đặc.
D. Dung dịch NaHCO3 bão hoà và dung dịch H2SO4 đặc.
Lời giải
A loại vì NaOH phản ứng với CO2 và HCl
B loại vì Na2CO3 phản ứng với CO2 và HCl
C loại vì H2SO4 đặc chỉ tách được nước, không tách được CO2 và HCl.
D đúng vì NaHCO3 chỉ phản ứng với HCl sinh ra khí CO2 và dung dịch H2SO4 để hút nước.
NaHCO3 + HCl →NaCl + CO2 + H2O
Đáp án: D
Bài 4: Người ta có thể rót khí CO2 từ cốc này sang cốc khác là do tính chất nào sau đây?
A. CO2 là chất nặng hơn không khí
B. CO2 là chất khí không màu, không mùi.
C. CO2 không duy trì sự cháy và sự sống.
D. CO2 bị nén và làm lạnh hóa rắn.
Lời giải
Người ta có thể rót khí CO2 từ cốc này sang cốc khác là do tính chất : CO2 là chất nặng hơn không khí
Đáp án: A
Bài 5: Có thể dùng thuốc thử nào sau đây để phân biệt khí CO2 và khí CO?
A. dung dịch NaCl.
B. dung dịch CuSO4.
C. dung dịch HCl.
D. dung dịch Ca(OH)2 dư.
Lời giải
Để phân biệt khí CO2 và khí CO, ta dùng dung dịch Ca(OH)2 dư vì CO2 tạo kết tủa trắng còn CO không phản ứng
CO2 + Ca(OH)2 → CaCO3 + H2O
Đáp án: D
Bài 6: Trong bình chữa cháy chứa khí nào sau đây?
A. Cl2. B. CO2.
C. SO2. D. O2
Lời giải
Trong bình chữa cháy chứa khí CO2
Đáp án: B
Bài 7: Dẫn luồng khí CO qua hỗn hợp Al2O3, CuO, MgO, Fe2O3 (nung nóng). Sau khi phản ứng xảy ra hoàn toàn thu được chất rắn là
A. Al2O3, Cu, MgO, Fe.
B. Al, Fe, Cu, Mg.
C. Al2O3, Cu, Mg, Fe.
D. Al2O3, Fe2O3, Cu, MgO.
Lời giải
Khí CO chỉ khử được các oxit kim loại đứng sau Al => khử được CuO và Fe2O3
Đáp án: A
Bài 8: Trong các phản ứng hoá học sau, phản ứng nào sai?
A. 3CO + Fe2O3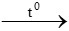 3CO2 + 2Fe
3CO2 + 2Fe
B. CO + Cl2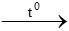 COCl2
COCl2
C. 3CO + Al2O3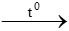 2Al + 3CO2
2Al + 3CO2
D. 2CO + O2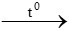 2CO2
2CO2
Lời giải
Phản ứng hóa học sai là 3CO + Al2O3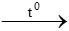 2Al + 3CO2 vì CO không khử được Al2O3
2Al + 3CO2 vì CO không khử được Al2O3
Đáp án: C
Bài 9: Để phòng nhiễm độc CO, là khí không màu, không mùi, rất độc người ta sử dụng mặt nạ với chất hấp phụ là
A. đồng (II) oxit và mangan oxit.
B. đồng (II) oxit và magie oxit.
C. đồng (II) oxit và than hoạt tính.
D. than hoạt tính.
Lời giải
Để phòng nhiễm độc CO, là khí không màu, không mùi, rất độc người ta dùng chất hấp thụ là than hoạt tính.
Vì CuO và MnO có phản ứng với CO nhưng ở nhiệt độ cao
MgO không phản ứng với CO
Đáp án: D
Bài 10: Sự hình thành thạch nhũ trong các hang động đá vôi là nhờ phản ứng hoá học nào sau đây?
A. CaCO3 + CO2 +H2O → Ca(HCO3)2
B. Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH
C. CaCO3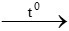 CaO + CO2
CaO + CO2
D. Ca(HCO3)2 → CaCO3 + CO2 + H2O
Lời giải
Sự hình thành thạch nhũ:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Sư xâm thực đá vôi (quá trình hòa tan núi đá vôi):
CaCO3 + CO2 +H2O → Ca(HCO3)2
Đáp án: D
Bài 11: Nhóm gồm các chất khí đều khử được CuO ở nhiệt độ cao là
A. CO, H2.
B. Cl2, CO2.
C. CO, CO2.
D. H2, C.
Đáp án: A
Bài 12: Phản ứng nào sau đây là sai?
Đáp án: D
CO chỉ khử được oxit của những kim loại đứng sau nhôm trong dãy hoạt động hóa học.
Bài 13: Đốt cháy 11,2 lít CO (đktc). Thể tích không khí cần cho phản ứng trên là
A. 21,4 lít.
B. 24 lít.
C. 26 lít.
D. 28 lít.
Đáp án: D
Số mol CO: nCO = 11,2 : 22,4 = 0,5 mol
Thể tích oxi cần dùng: Voxi = 0,25.22,5 = 5,6 lít
→ Thể tích không khí cần dùng: Vkk = 5,6.5 = 28 lít.
Bài 14: Quá trình nào sau đây làm giảm CO2 trong khí quyển?
A. Sự hô hấp của động vật và con người.
B. Cây xanh quang hợp.
C. Đốt than và khí đốt.
D. Quá trình nung vôi.
Đáp án: B
Bài 15: Cho 1 mol Ba(OH)2 phản ứng với 1 mol CO2. Muối tạo thành là
A. BaCO3.
B. Ba(HCO3)2.
C. BaCO3 và Ba(HCO3)2.
D. BaCO3 và Ba(OH)2 dư.
Đáp án: A
Bài 16: Khử hoàn toàn 4,8 gam đồng (II) oxit bằng khí CO. Thể tích khí CO cần dùng (đktc) là
A. 1,344 lít.
B. 1,12 lít.
C. 6,72 lít.
D. 4,48 lít.
Đáp án: A
Số mol CuO là: nCuO = 4,8 : 80 = 0,06 mol
→ VCO pư = 0,06.22,4 = 1,344 lít.
Bài 17: Người ta dùng 22 gam CO2 hấp thụ 20 gam NaOH. Khối lượng muối tạo thành là
A. 45 gam.
B. 44 gam.
C. 43 gam.
D. 42 gam.
Đáp án: D
Ta có:
Bài 18: Khử hoàn toàn 3,2 gam Fe2O3 bằng khí CO dư. Sản phẩm khí thu được cho vào bình đựng nước vôi trong dư được a gam kết tủa màu trắng. Giá trị của a là
A. 5,0.
B. 6,0.
C. 4,0.
D. 3,0.
Đáp án: B
Số mol Fe2O3 là 3,2 : 160 = 0,02 mol
Phương trình hóa học:
Vậy a = 0,06.100 = 6 gam.
Bài 19: Khí CO dùng làm chất đốt trong công nghiệp có lẫn tạp chất là CO2 và SO2. Có thể làm sạch CO bằng
A. CuSO4 khan.
B. H2SO4 đặc.
C. dung dịch BaCl2.
D. dung dịch nước vôi trong.
Đáp án: D
Cho hỗn hợp khí qua lượng dư nước vôi trong; CO2 và SO2 phản ứng với nước vôi trong bị giữ lại; CO không phản ứng thoát ra khỏi dung dịch thu được CO tinh khiết.
CO2 + Ca(OH)2 (dư) → CaCO3 ↓ + H2O
SO2 + Ca(OH)2 (dư) → CaSO3 ↓ + H2O
Bài 20: Để tạo muối KHCO3 duy nhất thì tỉ lệ CO2 sục vào dung dịch KOH là bao nhiêu ?
A. 1 : 3
B. 1 : 2
C. 1 : 1
D. 2 : 3
Đáp án: C