Tailieumoi.vn giới thiệu Giải sách bài tập Hóa học lớp 9 Bài 28: Các oxit của cacbon chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 9. Mời các bạn đón xem:
Giải SBT Hóa học 9 Bài 28: Các oxit của cacbon
Bài 28.1 trang 34 SBT Hóa học 9: Có 4 lọ đựng 4 khí riêng biệt : oxi, hiđro, clo và cacbon đioxit. Dựa vào tính chất của các chất, làm thế nào để nhận biết được mỗi khí trên ?
Phương pháp giải:
Dựa vào tính chất vật lí và hóa học khác nhau để nhận biết (dùng những hiện tượng đặc trưng).
Lời giải:
Bình nào có khí màu vàng lục là khí Cl2.
- Lần lượt cho 3 khí còn lại lội qua dd Ca(OH)2 dư, khí nào cho kết tủa trắng là CO2.
CO2 + Ca(OH)2 —> CaCO3 + H2O
- Trong 2 khí còn lại, khí nào làm bùng cháy tàn đóm đỏ là oxi, khí còn lại là H2.
Bài 28.2 trang 34 SBT Hóa học 9: So sánh tính chất hoá học của CO và C02. Cho các thí dụ minh hoạ.
Lời giải:
Giống nhau : CO và CO2 là oxit.
Khác nhau :
+ CO2 là oxit axit : CO2 + Ca(OH)2 —> CaCO3 + H2O.
CO là oxit trung tính.
+ CO2 là chất oxi hoá : C + CO2 —> 2CO.
CO là chất khử: 2CO + O2 —> 2CO2.
Bài 28.3 trang 34 SBT Hóa học 9: Một em học sinh làm thí nghiệm như sau : Cho một mẩu giấy quỳ tím vào ống nghiệm đựng nước cất, sau đó sục khí CO2 vào ống nghiệm. Màu của giấy quỳ tím có biến đổi không ? Nếu đun nóng nhẹ ống nghiệm thì màu của giấy quỳ tím biến đổi ra sao ? Hãy giải thích và viết các phương trình hoá học, nếu có.
Lời giải:
Khí CO2 tan một phần vào nước tạo thành dung dịch H2CO3 làm quỳ tím chuyển sang màu đỏ. Khi đun nóng nhẹ, độ tan của CO2 trong nước giảm, CO2 bay ra khỏi dung dịch, giấy quỳ trở lại màu tím ban đầu.
Bài 28.4 trang 35 SBT Hóa học 9: Có những khí sau :
A. Cacbon đioxit ; B. Clo ; C. Hiđro ;
D. Cacbon oxit ; E. Oxi.
Hãy cho biết, khí nào
a) có thể gây nổ khi đốt cháy với oxi.
b) có tính chất tẩy màu khi ẩm.
c) làm đổi màu dung dịch quỳ tím.
d) làm bùng cháy tàn đóm đỏ.
Phương pháp giải:
Xem tính chất hóa học của các hợp chất.
Lời giải:
a) Khí có thể gây nổ khi đốt cháy với oxi là khí H2.
2H2 + O2 → 2H2O
b) Khí có tính chất tẩy màu khi ẩm là khí Cl2.
Cl2 + H2O → HClO + HCl
c) Khí làm đổi màu dung dịch quỳ tím là khí cacbon đioxit.
H2O + CO2 → H2CO3
d) Khí làm bùng cháy tàn đóm đỏ là khí oxi.
Bài 28.5 trang 35 SBT Hóa học 9: Nung nóng 19,15 gam hỗn hợp CuO và PbO với một lượng cacbon vừa đủ trong môi trường không có oxi để oxit kim loại bị khử hết. Toàn bộ lượng khí sinh ra được dẫn vào dung dịch Ca(OH)2 dư, phản ứng xong người ta thu được 7,5 gam chất kết tủa màu trắng.
a) Viết phương trình hoá học của các phản ứng đã xảy ra.
b) Xác định thành phần phần trăm theo khối lượng của mỗi chất trong hỗn hợp ban đầu.
c) Tính khối lượng cacbon cần dùng cho phản ứng khử các oxit.
(Cho biết Cu : 64 ; Pb : 207.)
Phương pháp giải:
Lập hệ phương trình hai ẩn là số mol của 2 oxit. Tính toán theo phương trình hóa học.
Lời giải:
a) Phương trình hóa học:
x mol
y mol
0,075 mol
b) Ta có các phương trình:
80x + 223y = 19,15 (I)
(II)
Giải phương trình (I), (II), ta được: x =0,1 ; y=0,05
Vậy CuO chiếm khối lượng hỗn hợp đầu, còn PbO chiếm: 59%
c) .
Bài 28.6 trang 35 SBT Hóa học 9: Người ta cần dùng 7,84 lít khí CO (đktc) để khử hoàn toàn 20 gam hỗn hợp CuO và Fe203 ở nhiệt độ cao.
a) Viết các phương trình hoá học.
b) Xác định thành phần phần trăm theo khối lượng của mỗi chất trong hỗn hợp trước và sau phản ứng.
Phương pháp giải:
Lập và giải hệ phương trình 2 ẩn là số mol của hai oxit.
Lời giải:
Số mol CO = .
x mol x mol x mol x mol
y mol 3y mol 2y mol 3y mol
Ta có phương trình:
Bài 28.7 trang 35 SBT Hóa học 9: Quá trình nào sau đây không sinh ra khí cacbonic ?
A. Đốt cháy khí đốt tự nhiên.
B. Sản xuất vôi sống.
C. Quá trình hô hấp của người và động vật.
D. Quang hợp của cây xanh.
Phương pháp giải:
Xem chu trình của C trong tự nhiên (SGK).
Lời giải:
Quang hợp của cây xanh không sinh ra khí cacbonic .
Đáp án D.
Bài 28.8 trang 35 SBT Hóa học 9: Hàm lượng khí CO2 trong khí quyển của hành tinh chúng ta gần như là không đổi là vì
A. CO2 không có khả năng tác dụng với các chất khí khác trong không khí.
B. Trong quá trình quang hợp, cây xanh hấp thụ khí CO2, mặt khác một lượng CO2 được sinh ra do đốt cháy nhiên liệu, sự hô hấp của ngưòi và động vật...
C. CO2 hoà tan trong nước mưa.
D. CO2 bị phân hủy bởi nhiệt.
Lời giải:
Hàm lượng khí CO2 trong khí quyển của hành tinh chúng ta gần như là không đổi là vì trong quá trình quang hợp, cây xanh hấp thụ khí CO2, mặt khác một lượng CO2 được sinh ra do đốt cháy nhiên liệu, sự hô hấp của ngưòi và động vật...
Đáp án B.
Bài 28.9 trang 36 SBT Hóa học 9: Khí cacbon monooxit (CO) nguy hiểm là do có khả năng kết hợp với hemoglobin trong máu làm mất khả năng vận chuyển oxi của máu. Trong trường hợp nào sau đây, con người có thể bị tử vong do ngộ độc CO ?
A. Dùng bình gas để nấu nướng ở ngoài trời.
B. Đốt bếp lò trong nhà không được thông gió
C. Nổ (chạy) máy ôtô trong nhà xe đóng kín.
D. Cả trường hợp B và C.
Lời giải:
Khí cacbon monooxit (CO) nguy hiểm là do có khả năng kết hợp với hemoglobin trong máu làm mất khả năng vận chuyển oxi của máu. Con người có thể bị tử vong do ngộ độc CO khi đốt bếp lò trong nhà không được thông gió hoặc nổ (chạy) máy ôtô trong nhà xe đóng kín.
Đáp án D.
Bài 28.10 trang 36 SBT Hóa học 9: Khí CO và CO2 bị coi là chất làm ô nhiễm môi trường vì
A. Nồng độ (%V) CO cho phép trong không khí là 10-20 phần triệu, nếu đến 50 phần triệu sẽ có hại cho não.
B. CO2 tuy không độc nhưng gây hiệu ứng nhà kính làm Trái Đất nóng lên.
C. CO2 cần cho cây xanh quang hợp nên không gây ô nhiễm.
D. Cả hai nguyên nhân A và B.
Lời giải:
Khí CO và CO2 bị coi là chất làm ô nhiễm môi trường vì nồng độ (%V) CO cho phép trong không khí là 10-20 phần triệu, nếu đến 50 phần triệu sẽ có hại cho não và CO2 tuy không độc nhưng gây hiệu ứng nhà kính làm Trái Đất nóng lên.
Đáp án D.
Bài 28.11 trang 36 SBT Hóa học 9: Cacbon và oxi phản ứng theo phương trình hoá học sau : . Nếu cho 1,20 gam cacbon phản ứng với 1,68 lít khí oxi (đktc) thì lượng tối đa cacbon đioxit sinh ra là :
A. 1,8 lít ; B. 1,68 lít ;
C. 1,86 lít; D. 2,52 lít.
Phương pháp giải:
Tính toán theo phương trình hóa học.
Lời giải:
Đáp án B.
Phương trình hóa học :
0,075 mol 0,075 mol 0,075 mol
Số mol C dư nên tính số mol theo . Theo phương trình hóa học trên, số mol là 0,075 mol --->
Bài 28.12 trang 36 SBT Hóa học 9: Khí CO sinh ra thường có lẫn một phần khí CO2. Hãy giới thiệu hai phương pháp hoá học có thể thu được khí CO trong phòng thí nghiệm và viết các phương trình hoá học.
Phương pháp giải:
Dựa vào tính chất hóa học khác nhau giữa hai khí.
Lời giải:
- Dẫn hỗn hợp khí CO và CO2 đi qua dung dịch NaOH hoặc Ca(OH)2. Khí ra khỏi dung dịch kiềm là khí CO vì khí CO2 đã tác dụng với dung dịch NaOH hoặc Ca(OH)2.
CO2 + 2NaOH -------- > Na2CO3 +H2O
CO2 + Ca(OH)2 ---------> CaCO3 + H2O
- Hoặc dẫn hỗn hợp khí qua canxi oxit (CaO), khí đi ra là khí CO.
Bài 28.13 trang 36 SBT Hóa học 9:
Qua thí nghiệm ở hình vẽ 3.4, em hãy viết phương trình hoá học của phản ứng xảy ra. Phản ứng hoá học này thuộc loại phản ứng nào ?
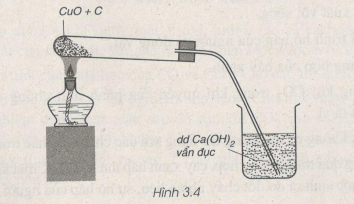
Phương pháp giải:
Xem lí thuyết tính chất hóa học của C.
Lời giải:
Phương trình hóa học:
Phản ứng này là phản ứng oxi hóa -khử.