Với tóm tắt lý thuyết Hóa học lớp 9 Axit cacbonic và muối cacbonat hay, chi tiết cùng với 19 câu hỏi trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học lớp 9.
Hóa học 9 Bài 29: Axit cacbonic và muối cacbonat
A. Lý thuyết Axit cacbonic và muối cacbonat
1. Trạng thái tự nhiên và tính chất vật lí
Trong nước tự nhiên và nước mưa có hòa tan khí cacbonic: 1000 m3 nước hòa tan được 90 m3 khí CO2.
Một phần khí CO2 tác dụng với nước tạo thành dung dịch axit cacbonic, phần lớn vẫn tồn tại ở dạng phân tử CO2
2. Tính chất hóa học
- H2CO3 là một axit yếu: dung dịch H2CO3 chỉ làm quỳ tím chuyển thành màu đỏ nhạt, bị axit mạnh đẩy ra khỏi muối.
- H2CO3 là một axit không bền: H2CO3 tạo thành trong các phản ứng hóa học bị phân hủy ngay thành CO2 và H2O.
1. Phân loại:
Có hai loại muối cacbonat:
- Muối cacbonat trung hòa (hay muối cacbonat), không còn nguyên tố H trong thành phần gốc axit.
Ví dụ: Na2CO3, CaCO3,..
- Muối cacbonat axit (hay muối hiđro cacbonat), có nguyên tố H trong thành phần gốc axit.
Ví dụ: NaHCO3, Ca(HCO3)2...
2. Tính chất
a) Tính tan:
Đa số muối cacbonat không tan trong nước, trừ một số muối cacbonat của kim loại kiềm như Na2CO3, K2CO3...
Hầu hết các muối hiđro cacbonat tan trong nước như Ca(HCO3)2; Mg(HCO3)2 …
b) Tính chất hóa học
- Tác dụng với axit:
Muối cacbonat tác dụng với dung dịch axit mạnh hơn axit cacbonic (như HCl, HNO3, H,SO4,...) tạo thành muối mới và giải phóng CO2.
Ví dụ:
NaHCO3 + HCl → NaCl + CO2↑ + H2O
CaCO3 + H2SO4 → CaSO4 + CO2 ↑+ H2O
- Tác dụng với dung dịch bazơ
Một số dung dịch muối cacbonat tác dụng với dung dịch bazơ tạo thành muối cacbonat không tan và bazơ mới.
Ví dụ:
K2CO3 + Ca(OH)2 → 2KOH + CaCO3 ↓
Muối hiđro cacbonat tác dụng với dung dịch kiềm tạo thành muối trung hòa và nước
Ví dụ:
KHCO3 + KOH → K2CO3 + H2O
Ba(HCO3)2 + Ba(OH)2 → 2BaCO3↓ + 2H2O
- Tác dụng với dung dịch muối
Dung dịch muối cacbonat tác dụng với một số dung dịch muối tạo thành 2 muối mới
Ví dụ:
Na2CO3 + CaCl2 → 2NaCl + CaCO3↓
- Muối cacbonat bị nhiệt phân hủy
Nhiều muối cacbonat (trừ muối cacbonat trung hòa của kim loại kiềm) dễ bị nhiệt phân hủy giải phóng khí CO2
Ví dụ:
3. Ứng dụng:
- CaCO3 là thành phần chính của đá vôi, được dùng để sản xuất vôi, xi măng…
- Na2CO3 được dùng để nấu xà phòng, sản xuất thủy tinh,..
- NaHCO3 được dùng làm dược phẩm, hóa chất trong bình cứu hỏa,...
Trong tự nhiên luôn có sự chuyển hóa cacbon tự dạng này sang dạng khác. Sự chuyển hóa này diễn ra thường xuyên, liên tục và tạo thành chu trình khép kín.
B. Trắc nghiệm Axit cacbonic và muối cacbonat
Bài 1: Có các chất rắn màu trắng, đựng trong các lọ riêng biệt không nhãn : CaCO3, NaCl, NaOH. Nếu dùng quỳ tím và nước thì có thể nhận ra
A. 1 chất
B. 2 chất
C. 3 chất
D. không nhận được
Lời giải
- Cho nước vào các mẫu chất rắn, mẫu không tan trong nước là CaCO3, 2 mẫu tan trong nước là NaCl và NaOH
- Dùng quỳ tím để nhận biết 2 dung dịch của 2 mẫu tan, dung dịch không làm đổi màu quỳ là NaCl, dung dịch làm đổi màu quỳ là NaOH
Đáp án: C
Bài 2: Tính thể tích khí CO2 (đktc) tạo thành để dập tắt đám cháy nếu trong bình chữa cháy có dung dịch chứa 980 gam H2SO4 tác dụng hết với dung dịch NaHCO3.
A. 22,4 lít.
B. 224 lít.
C. 44,8 lít.
D. 448 lít.
Lời giải
H2SO4 + 2NaHCO3 → Na2SO4 + 2CO2 + 2H2O
98 gam → 2.22,4 lít
980 gam → 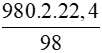 = 448 lít
= 448 lít
Vậy thể tích CO2 tạo thành là 448 lít
Đáp án: D
Bài 3: Hãy xác định công thức hóa học của muối natri cacbonat ngậm nước biết rằng khi nung 3,1 gam tinh thể này đến khối lượng không đổi được chất rắn có khối lượng là 2,65 gam
A. Na2CO3.H2O
B. Na2CO3.2H2O
C. 2Na2CO3.H2O
D. Na2CO3.3H2O
Lời giải
Đặt CTPT của muối cacbonat ngậm nước là: x.Na2CO3.yH2O
Khi nung thu được muối khan:
x.Na2CO3.yH2O 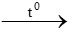 xNa2CO3 + yH2O
xNa2CO3 + yH2O
Chất rắn có khối lượng 2,65 gam là Na2CO3
=> 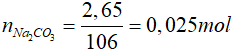
Bảo toàn khối lượng: mtinh thể = mH2O + m Na2CO3
mH2O = 3,1 - 2,65 = 0,45 gam => nH2O = 0,025 mol
Tỉ lệ x : y = 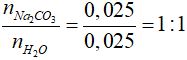
Vậy CTPT của muối cacbonat ngậm nước là Na2CO3.H2O
Đáp án: A
Bài 4: Sự tạo thành thạch nhũ trong các hang động của mỏ đá vôi là do có phản ứng:
A. CaCO3 + CO2 + H2O → Ca(HCO3)2.
B. Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH.
C. CaCO3 → CaO + H2O.
D. Ca(HCO3)2 → CaCO3 + CO2 + H2O.
Lời giải
Thạch nhũ là CaCO3
Sự tạo thành thạch nhũ trong các hang động của mỏ đá vôi là do có phản ứng :
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Đáp án: D
Bài 5: Hãy cho biết trong các cặp chất sau đây, cặp nào không thể tác dụng với nhau?
A. H2SO4 và KHCO3
B. K2CO3 và NaCl
C. MgCO3 và HCl
D. CaCl2 và Na2CO3
Lời giải
Những cặp chất tác dụng với nhau:
A. H2SO4+ 2KHCO3 → K2SO4 + 2CO2 ↑ + 2H2O
C. MgCO3+ 2HCl → MgCl2 + CO2 ↑ + H2O
D. CaCl2+ Na2CO3 → CaCO3 ↓ + 2NaCl
Cặp chất không tác dụng với nhau là B. K2CO3 và NaCl
Đáp án: B
Bài 6: Quá trình thổi khí CO2 vào dung dịch NaOH, muối tạo ra theo thứ tự là :
A. NaHCO3, Na2CO3
B. Na2CO3, NaHCO3
C. Na2CO3
D. Không đủ dữ liệu xác định
Lời giải
Ban đầu tạo muối NaCO3
CO2 + 2NaOH → Na2CO3 + H2O
Sau đó, CO2 dư tiếp tục xảy ra phản ứng:
CO2 + Na2CO3 + H2O → 2NaHCO3
Đáp án: B
Bài 7: Có 4 chất rắn: NaCl, Na2CO3, CaCO3, BaSO4 chỉ dùng thêm một cặp chất nào dưới đây để nhận biết ?
A. H2O và CO2
B. H2O và NaOH
C. H2O và HCl
D. H2O và BaCl2
Lời giải
- Cho nước cất vào cả 4 mẫu chất rắn trên, mẫu không tan trong nước là CaCO3 và BaSO4 (nhóm I), 2 mẫu tan trong nước là NaCl và Na2CO3 (nhóm II)
- Cho dung dịch HCl vào các mẫu ở cả 2 nhóm.
+ Nhóm I: mẫu xuất hiện khí thoát ra là CaCO3, mẫu không hiện tượng là BaSO4
PTHH: CaCO3 + 2HCl → CaCl2 + CO2 + H2O
+ Nhóm II: mẫu xuất hiện khí thoát ra là Na2CO3, mẫu không hiện tượng là NaCl
PTHH: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
Đáp án: C
Bài 8: Cho luồng khí H2 dư qua hỗn hợp các oxit CuO, Fe2O3, ZnO, MgO nung nóng ở nhiệt độ cao. Sau phản ứng, hỗn hợp chất rắn còn lại là
A. Cu, Fe, ZnO, MgO.
B. Cu, Fe, Zn, Mg.
C. Cu, Fe, Zn, MgO.
D. Cu, FeO, ZnO, MgO.
Các chất khử C, CO, H2 không khử được các oxit MgO, Al2O3 và các oxit khác của kim loại kiềm và kiềm thổ
⇒ chỉ khử được CuO, Fe2O3, ZnO tạo thành Cu, Fe, Zn
⇒ hỗn hợp chất rắn thu được là Cu, Fe, Zn, MgO.
Đáp án: C
Bài 9: Cho khí CO (dư) đi vào ống sứ nung nóng đựng hỗn hợp X gồm Al2O3, MgO, Fe3O4, CuO thu được chất rắn Y. Cho Y vào dung dịch NaOH (dư), khuấy kĩ, thấy còn lại phần không tan Z. Giả sử các phản ứng xảy ra hoàn toàn. Phần không tan Z gồm:
A. MgO, Fe3O4, Cu.
B. MgO, Fe, Cu.
C. Mg, Fe, Cu.
D. Mg, Al, Fe, Cu.
Các chất khử C, CO, H2 không khử được các oxit MgO, Al2O3 và các oxit khác của kim loại kiềm và kiềm thổ.
⇒ trong hỗn hợp X, CO khử được Fe3O4 và CuO tạo ra Fe và Cu
⇒ chất rắn Y gồm: Al2O3, MgO, Fe, Cu
Cho Y vào dung dịch NaOH dư, chỉ có Al2O3 tan ⇒ chất rắn Z sau phản ứng gồm MgO, Fe, Cu
Đáp án: B
Bài 10: Khử hoàn toàn 32 gam CuO bằng khí CO dư, thu được m gam kim loại. Giá trị của m là
A. 12,8
B. 25,6
C. 32,0
D. 64,0
Đáp án: B
Bài 11: Cho khí CO dư đi qua ống chứa 0,2 mol MgO và 0,2 mol CuO nung nóng đến phản ứng hoàn toàn, thu được x gam chất rắn. Giá trị của x là
A. 17,6
B. 4,8
C. 20,8
D. 24,0
Đáp án: C
Bài 12: Cho luồng khí CO (dư) đi qua 9,1 gam hỗn hợp gồm CuO và Al2O3 nung nóng đến khi phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là
A. 0,8 gam.
B. 8,3 gam.
C. 2,0 gam.
D. 4,0 gam.
Gọi số mol của CuO và Al2O3 lần lượt là a và b mol
⇒ mhỗn hợp đầu = 80a + 102b = 9,1 (1)
Khí CO chỉ phản ứng với CuO
Hỗn hợp chất rắn sau phản ứng gồm Cu (a mol) và Al2O3 (b mol)
⇒ mhỗn hợp sau = 64a + 102b = 8,3 (2)
Lấy (1) trừ (2) ta có: 16a = 0,8 ⇒ a = 0,05 mol
⇒ mCuO = 0,05.80 = 4 gam
Đáp án: D
Bài 13: Cho V lít khí CO (ở đktc) phản ứng với một lượng dư hỗn hợp rắn gồm CuO và Fe2O3 nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng hỗn hợp rắn giảm 0,32 gam. Giá trị của V là
A. 0,224
B. 0,560
C. 0,112
D. 0,448
Giả sử khối lượng hỗn hợp rắn ban đầu là m gam ⇒ khối lượng rắn sau phản ứng là (m – 0,32) gam
Đáp án: D
Bài 14: Dẫn từ từ V lít khí CO (ở đktc) đi qua một ống sứ đựng lượng dư hỗn hợp rắn gồm CuO, Fe2O3 (ở nhiệt độ cao). Sau khi các phản ứng xảy ra hoàn toàn, thu được khí X. Dẫn toàn bộ khí X ở trên vào lượng dư dung dịch Ca(OH)2 thì tạo thành 4 gam kết tủa. Giá trị của V là
A. 0,896
B. 1,120
C. 0,224
D. 0,448
Đáp án: A
Bài 15: Hoà tan hoàn toàn 20 gam một oxit kim loại bằng dung dịch H2SO4 loãng thu được 50 gam muối. Khử hoàn toàn lượng oxit đó thành kim loại ở nhiệt độ cao cần V lít khí CO (đktc). Giá trị của V là
A. 2,80
B. 5,60
C. 6,72
D. 8,40
| n | 1 | 2 | 3 | 4 |
| R | 18,67 (loại) | 37,33 (loại) | 56 (Fe) | 74,67 (loại) |
Đáp án: D
Bài 16: Cho H2 dư qua 8,14 gam hỗn hợp A gồm CuO, Al2O3 và FexOy nung nóng. Sau khi phản ứng xong, thu được 1,44 gam H2O và a gam chất rắn. Giá trị của a là :
A. 6,70
B. 6,86
C. 6,78
D. 6,80
Đáp án: A
Bài 17: Khử 3,48 gam một oxit của kim loại M cần dùng 1,344 lít H2 (đktc). Toàn bộ lượng kim loại M sinh ra cho tác dụng với dung dịch HCl dư thu được 1,008 lít H2 (đktc). Công thức oxit là
A. Fe3O4.
B. Fe2O3.
C. FeO.
D. ZnO.
| n | 1 | 2 | 3 | 4 |
| M | 21 (loại) | 42 (loại) | 63 (loại) | 84 (loại) |
Đáp án: A
Bài 18: Cho khí CO qua ống chứa 15,2 gam hỗn hợp A gồm CuO và FeO nung nóng. Sau một thời gian thu được hỗn hợp khí B và 13,6 gam chất rắn
C. Cho B tác dụng với dung dịch Ca(OH)2 dư thu được m gam kết tủa. Giá trị của m là :
A. 15
B. 10
C. 20
D. 25
Đáp án: B
Bài 19: Dẫn một luồng khí CO dư qua ống sứ đựng m gam hỗn hợp Fe3O4 và CuO nung nóng đến khi phản ứng hoàn toàn thu được 2,32 gam hỗn hợp kim loại. Khí thoát ra khỏi bình được dẫn qua dung dịch nước vôi trong dư thu được 5 gam kết tủa. Giá trị của m là :
A. 6,24
B. 5,32
C. 3,12
D. 4,56
Đáp án: C