Tailieumoi.vn giới thiệu Giải bài tập Hóa học 9 Bài 28: Các oxit của cacbon chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Các oxit của cacbon lớp 9.
Giải bài tập Hóa học 9 Bài 28: Các oxit của cacbon
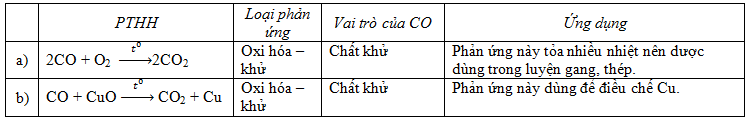
Bài 1 trang 87 SGK Hóa học 9: Hãy viết phương trình hoá học của CO với:
a) khí O2 ;
b) CuO.
Cho biết: loại phản ứng ; điều kiện phản ứng ; vai trò của CO và ứng dụng của mỗi phản ứng đó.
Lời giải:
Bài 2 trang 87 SGK Hóa học 9: Hãy viết phương trình hoá học của CO2 với dung dịch NaOH, dung dịch Ca(OH)2 trường hợp:
a) Tỉ lệ số mol : nNa0H = 1:1;
b) Tỉ lệ số mol : nCa(0H)2 = 2:1
Lời giải:
a) Sản phẩm của phản ứng là : NaHCO3
Phương trình hóa học: CO2 + NaOH -> NaHCO3
b) Sản phẩm của phản ứng là: Ca(HCO3)2
Phương trình hóa học: 2CO2 + Ca(OH)2 -> Ca (HCO3)2
Bài 3 trang 87 SGK Hóa học 9: Có hỗn hợp hai khí CO và CO2. Nêu phương pháp hoá học để chứng minh sự có mặt của hai khí đó. Viết các phương trình hoá học.
Phương pháp giải:
Lời giải:
Chứng minh sự có mặt của CO2 và CO bằng cách: Cho hỗn hợp khí lội qua bình chứa dung dịch nước vôi trong dư, nếu nước vôi trong vẩn đục, chứng tỏ trong hỗn hợp có khí CO2. Khí đi ra từ bình nước vôi trong được dẫn qua ống thủy tinh đựng CuO (màu đen), nung nóng, nếu thấy có chất rắn màu đỏ (là Cu) xuất hiện và khí sinh ra làm đục nước vôi trong, chứng tỏ trong hỗn hợp có khí CO.
Phương trình hóa học:
CO2 + Ca(OH)2 -> CaCO3 + H2O
CO + CuO (màu đen) CO2 + Cu (màu đỏ)
Bài 4 trang 87 SGK Hóa học 9: Trên bề mặt các hố nước vôi tôi lâu ngày thường có lớp màng chất rắn. Hãy giải thích hiện tượng này và viết phương trình hoá học.
Phương pháp giải:
Lời giải:
Màng rắn đó là: CaCO3 vì trong nước vôi tôi có chứa Ca(OH)2 dưới dạng hòa tan vào nước (nước vôi trong) và trong không khí có khí CO2 nên xảy ra phản ứng tạo kết tủa CaCO3
PTHH: CO2 + Ca(OH)2 -> CaCO3 + H2O.
Bài 5 trang 87 SGK Hóa học 9: Hãy xác định thành phần % về thể tích của mỗi khí trong hỗn hợp CO và CO2, biết các số liệu thực nghiệm sau :
- Dẫn 16 lít hỗn hợp CO và CO2 qua nước vôi trong dư thu được khí A.
- Để đốt cháy hoàn toàn khí A cần 2 lít khí oxi.
Các thể tích khí được đo ở cùng điều kiện nhiệt độ và áp suất.
Phương pháp giải:
- Đối với chất khí, khi đo cùng điều kiện về nhiệt độ, áp suất thì trong phương trình hóa học, tỉ lệ về số mol cũng là tỉ lệ về thể tích khí.
- Khi dẫn hỗn hợp CO, CO2 qua nước vôi trong dư, toàn bộ CO2 bị hấp thụ hết do phản ứng với Ca(OH)2. Khí A là khí CO.
- Viết PTHH khi đốt cháy CO trong oxi. Đặt thể tích oxi vào và suy ra thể tích CO, từ đó tính được thể tích CO2 và tính phần trăm thể tích mỗi khí trong hỗn hợp.
Lời giải:
Dẫn hỗn hợp khí CO và CO2 qua nước vôi trong dư thu được khí A là khí CO, trong cùng điều kiện về nhiệt độ và áp suất thì tỷ lệ thể tích cũng bằng tỷ lệ về số mol
Phương trình phản ứng đốt cháy khí A:
Từ phương trình trên ta nhận thấy:
(lít) (tỷ lệ về số mol cũng chính là tỷ lệ về thể tích)
I. CACBON OXIT
- Công thức phân tử: CO
- Phân tử khối: 28
1. Tính chất vật lí
CO là chất khí không màu, không mùi, ít tan trong nước, hơi nhẹ hơn không khí, rất độc.
2. Tính chất hóa học
a) CO là oxit trung tính
- Ở nhiệt độ thường, CO không phản ứng với nước, kiềm và axit.
b) CO là chất khử
- Ở nhiệt độ cao, CO khử được nhiều oxit kim loại
+ CO khử CuO theo phương trình: CuO(đen) + CO CO2 + Cu(đỏ)
+ CO khử oxit sắt trong lò cao: 4CO + Fe3O4 4CO2 + 3Fe
+ CO cháy trong oxi hoặc trong không khí với ngọn lửa xanh, tỏa nhiều nhiệt:
2CO + O2 2CO2
3. Ứng dụng
- Làm nhiên liệu, chất khử, nguyên liệu trong công nghiệp hóa học.
II. CACBON ĐIOXIT
- Công thức phân tử: CO2
- Phân tử khối: 44
1. Tính chất vật lí
- CO2 là chất khí không màu, không mùi, nặng hơn không khí, không duy trì sự cháy. CO2 bị nén và làm lạnh thì hóa rắn, tạo thành “nước đá khô”
2. Tính chất hóa học: CO2 có tính chất của một oxit axit.
a) Tác dụng với nước
CO2 + H2O H2CO3
Khí CO2 phản ứng với nước tạo thành dung dịch axit yếu là H2CO3 làm quỳ chuyển đỏ, H2CO3 không bền nên khi đun nóng dung dịch sẽ làm quỳ chuyển lại màu tím.
b) Tác dụng với dung dịch bazơ
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3
Tùy thuộc vào tỉ lệ giữa số mol CO2 và NaOH mà có thể tạo ra muối trung hòa, muối axit hay cả 2 muối.
c) Tác dụng với oxit bazơ
CO2 + CaO → CaCO3
3. Ứng dụng
Người ta sử dụng CO2 để chữa cháy, bảo quản thực phẩm. CO2 còn được dùng trong sản xuất nước giải khát có gas, sản xuất sođa, phân đạm,...
Sơ đồ tư duy: Các oxit của cacbon
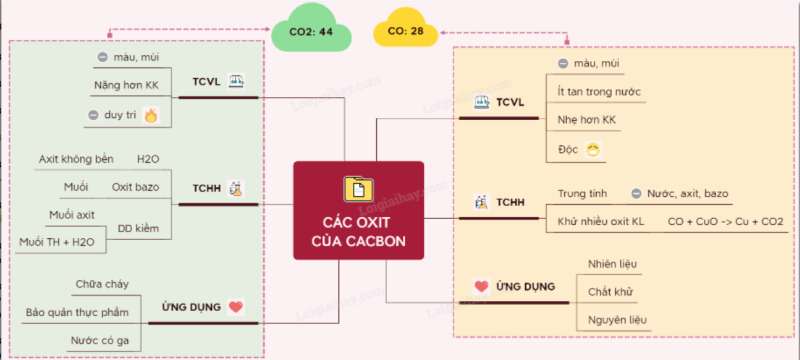
* Một số ví dụ điển hình
Câu 1: Phát biểu nào dưới đây đúng:
A. CO là chất khí không màu, không mùi, tan nhiều trong nước.
B. CO có tính khử mạnh, ở nhiệt độ cao, khí CO khử được hầu hết các oxit kim loại trước Al
C. CO là oxit không tạo muối( oxit trung tính).
D. Khí CO rất độc, nó được dùng để khử oxit nhôm.
Hướng dẫn giải chi tiết:
A sai: CO tan ít trong nước
B sai: CO chỉ khử được các oxit sau Al
D sai: CO không khử được oxit Al
Đáp án C
Câu 2: Không dùng khí CO2 để dập tắt đám cháy nào sau đây:
A. CH4
B. Mg
C. Al
D. H2
Hướng dẫn giải chi tiết:
Lưu ý: Mg cháy được trong CO2
2Mg + CO2 →2MgO + C
Đáp án B
Câu 3: Một chất khí X có tính chất sau:
- Nặng hơn không khí
- Không duy trì sự cháy
- Làm đục nước vôi trong
Vậy chất X có thể là:
A. CO2
B. Cl2
C. O2
D. N2
Hướng dẫn giải chi tiết
Dựa vào đặc điểm tính chất đã biết của các khí trên, chất phù hợp với đề bài là CO2
Đáp án A
Câu 4: Khi dẫn từ từ khí CO2 vào dung dịch nước vôi trong cho đến dư. Hiện tượng có thể quan sát được là:
A. Xuất hiện kết tủa keo trắng
B. Dung dịch vẩn đục
C. Dung dịch vẩn đục, sau đó trong trở lại
D. Không thấy hiện tượng gì xảy ra
Hướng dẫn giải chi tiết:
Khi sục khí CO2 xảy ra phản ứng tạo kết tủa
Ca(OH)2 + CO2 → CaCO3↓+ H2O
Khi sục khí CO2 dư xảy ra phản ứng hòa tan kết tủa
CaCO3 + H2O + CO2 → Ca(HCO3)2
Đáp án C
Dạng 2: Bài toán về CO khử oxit kim loại
* Một số lưu ý cần nhớ
CO có thể khử oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học
Sản phẩm sinh ra gồm CO2 và kim loại tương ứng.
Ta có phương trình tổng quát
CO + M2On →2M + nCO2 (1)
Để làm được dạng bài tập này, người ta thường áp dụng định luật bảo toàn khối lượng và bảo toàn nguyên tố oxi
(1) n O trong oxit kim loại = n CO phản ứng = n CO2 sinh ra
* Một số ví dụ điển hình
Câu 1: Tính thể tích khí CO cần để khử hoàn toàn 24 g hỗn hợp CuO và Fe2O3 có tỉ lệ mol 1 : 1
Hướng dẫn giải chi tiết:
nCuO : nFe2O3 = 1: 1
=> Gọi số mol của CuO là x thì số mol của Fe2O3 = x (mol)
Tổng khối lượng hỗn hợp: 80x + 160x = 24 => x = 0,1 (mol)
CuO + CO → Cu + CO2
0,1 → 0,1
3CO + Fe2O3 → 2Fe + 3CO2
0,3 ← 0,1
=> nCO = 0,1 + 0,3 = 0,4 mol
=> VCO cần = 0,4 . 22,4 = 8,96 lít
Câu 2: Nung nóng 38,3 g hỗn hợp PbO và CuO với một lượng CO vừa đủ. Toàn bộ lượng khí sinh ra được dẫn qua dung dịch Ca(OH)2 dư, phản ứng xong người ta thu được 30 g kết tủa màu trắng. Khối lượng của mỗi oxit kim loại trong hỗn hợp ban đầu là:
Hướng dẫn giải chi tiết:
Gọi x, y lần lượt là số mol của PbO và CuO
Ta có mhh = mPbO + mCuO = 223x + 80y = 38,3 (1)
n kết tủa = m kết tủa : M kết tủa = 30 : 100 = 0,3mol
PbO + CO → CO2 + Pb
x x
CuO + CO → CO2 + Cu
y y
CO2 + Ca(OH)2 → CaCO3 + H2O
x + y x + y
ta có n kết tủa = x + y = 0,3 mol (2)
Giải hệ (1) và (2) ta có x = 0,1 và y = 0,2
=> mPbO = nPbO . MPbO = 0,1 . (207 + 16) = 22,3g
mCuO = mhh – mPbO = 38,3 – 22,3 = 16g
Câu 3: Khử hoàn toàn 28 gam hỗn hợp gồm CuO và Fe2O3 cần vừa đủ 10,08 lít khí CO (đktc) thu được a gam hỗn hợp rắn. Xác định giá trị của a ?
Hướng dẫn giải chi tiết:
nCO = 10,08/22,4 = 0,45 mol
Bảo toàn nguyên tố C ta có:
CO → CO2
0,45→0,45 (mol)
Áp dụng định luật bảo toàn khối lượng ta có:
m oxit + mCO = m chất rắn + mCO2
=> 28 + 0,45.28 = mchất rắn + 0,45.44
=> m chất rắn = 20,8 gam
Vậy a = 20,8 gam
Dạng 3: Bài toán CO2 tác dụng với dung dịch kiềm
* Một số lưu ý cần nhớ
Ta có phương trình hóa học:
CO2 + NaOH- → NaHCO3 (Natri hidrocacbonat)
CO2 + 2NaOH- → Na2CO3 + H2O
Natri cacbonat
Đặt T =
Ta có:
|
Giá trị của T |
Chất thu được sau phản ứng |
|
T = 1 |
Muối hidro cacbonat |
|
T = 2 |
Muối cacbonat |
|
T < 1 |
Muối hidro cacbonatvà CO2 dư |
|
T > 2 |
Muối cacbonatvà dung dịch kiềm dư |
|
1 < T < 2 |
Muối hidro cacbonat và muối cacbonat |
Một số ví dụ điển hình:
Câu 1: Sục 5,6 lít khí CO2(đktc) vào V lít dung dịch NaOH 0,04M. Kết thúc phản ứng thu được muối trung hòa Na2CO3. Giá trị của V và nồng độ mol/l của muối thu được là: (Giả sử thể tích sau phản ứng không thay đổi)
Hướng dẫn giải chi tiết:
PTHH: CO2 + 2NaOH → Na2CO3+ H2O
nCO2 = 0,25 mol → nNaOH = 0,5 mol → V = 0,5 : 0,04 = 12,5 lít
Nồng đô mol/l của dung dịch muối là 0,25 : 12,5 = 0,02 lít
Câu 2: Dẫn V lít khí CO2 (đktc) đi qua 200 ml dung dịch Ca(OH)2 1M. Sau khi phản ứng kết thúc thu được 10 gam kết tủa. Giá trị của V là
Hướng dẫn giải chi tiết:
So sánh < xác định có 2 trường hợp.
TH1: Chỉ xảy ra một phản ứng tạo CaCO3 từ đó tính .
TH2: Xảy ra cả hai phản ứng tạo muối CaCO3 và Ca(HCO3)2 từ đó tính .
Lời giải chi tiết:
CO2 + Ca(OH)2 → CaCO3 + H2O
0,1 0,1 ← 0,1 (mol)
⟹ mol.
⟹ V = 0,1.22,4 = 2,24 lít.
TH2: Xảy ra cả hai phản ứng tạo muối CaCO3 và Ca(HCO3)2
CO2 + Ca(OH)2 → CaCO3 + CO2.
0,1 0,1 ← 0,1 (mol)
2CO2 + Ca(OH)2 → Ca(HCO3)2.
0,2 ← 0,1 (mol)
⟹ mol
⟹ V= 0,3.22,4 = 6,72 lít.
Câu 3: Dẫn 15,68 lít khí CO2 (đktc) qua V ml dung dịch Ca(OH)2 2M thu được dung dịch A và kết tủa B với tổng khối lượng muối 62,4 gam. Giá trị của V là
Hướng dẫn giải chi tiết:
Sau phản ứng thu được dung dịch A và kết tủa B ⟹ Phản ứng tạo hai muối Ca(HCO3)2 và CaCO3.
Gọi số mol của CaCO3 và Ca(HCO3)2 lần lượt là a và b (mol).
Phương trình tổng khối lượng muối (1).
Ca(OH)2 + CO2 → CaCO3 + H2O
Ca(OH)2 + CO2 → Ca(HCO3)2
Theo PTHH tính được số mol CO2 (2)
Từ (1) và (2) tính được số mol Ca(OH)2. ⟹ V.
Sau phản ứng thu được dung dịch A và kết tủa B ⟹ Phản ứng tạo hai muối Ca(HCO3)2 và CaCO3.
Lời giải chi tiết:
Gọi số mol của CaCO3 và Ca(HCO3)2 lần lượt là a và b (mol).
⟹ 100a + 162b = 62,4 (1)
CO2 + Ca(OH)2 → CaCO3 + CO2
a a ← a (mol)
2CO2 + Ca(OH)2 → Ca(HCO3)2
2b b ← b (mol)
Theo PTHH ⟹ (2)
Từ (1) và (2) ⟹ a = 0,3, b = 0,2.
⟹ mol.
⟹ lít = 250ml.