Với tóm tắt lý thuyết Hóa học lớp 9 Tính chất của phi kim hay, chi tiết cùng với 20 câu hỏi trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học lớp 9.
Hóa học 9 Bài 25: Tính chất của phi kim
A. Lý thuyết Tính chất của phi kim
Ở điều kiện thường: Phi kim có thể tồn tại ở trạng thái rắn như C, S, P, Si, I2,...; trạng thái lỏng như: Br2; trạng thái khí như: O2, H2, N2, …
Phần lớn phi kim không dẫn điện, dẫn nhiệt và có nhiệt độ nóng chảy thấp.
Một số phi kim độc như clo, brom, iot.
1. Tác dụng với kim loại
- Oxi tác dụng với kim loại tạo thành oxit
Ví dụ:
- Các phi kim khác tác dụng với kim loại tạo thành muối
Ví dụ:
2. Tác dụng với hiđro
- Oxi tác dụng với hiđro tạo thành hơi nước
Phương trình hóa học:
- Các phi kim khác (như C; S; Cl2; Br2…) tác dụng với hiđro tạo thành hợp chất khí
Ví dụ:
Khí hiđro clorua tan trong nước tạo thành axit clohiđric và làm quỳ tím hóa đỏ.
3. Tác dụng với oxi
Nhiều phi kim tác dụng với oxi tạo thành oxit axit
Ví dụ:
4. Mức độ hoạt động của phi kim
Mức độ hoạt động mạnh hay yếu của phi kim thường được xét căn cứ vào khả năng và mức độ phản ứng của phi kim đó với kim loại và hiđro.
Các phi kim như flo, oxi, clo là những phi kim hoạt động hóa học mạnh, trong đó flo là phi kim mạnh nhất. Lưu huỳnh, photpho, cacbon, silic là những phi kim hoạt động yếu hơn.
B. Trắc nghiệm Tính chất của phi kim
Bài 1: Để so sánh mức độ hoạt động mạnh, yếu của phi kim thường được xem xét qua khả năng phản ứng của phi kim đó với:
A. Hiđro hoặc với kim loại
B. Dung dịch kiềm
C. Dung dịch axit
D. Dung dịch muối
Lời giải
Để so sánh mức độ hoạt động mạnh, yếu của phi kim thường được xem xét qua khả năng phản ứng của phi kim đó với hiđro hoặc với kim loại
Đáp án: A
Bài 2: Mức độ hoạt động hóa học mạnh hay yếu của phi kim được xét căn cứ vào khả năng và mức độ phản ứng của phi kim đó với
A. oxi và kim loại.
B. hiđro và oxi.
C. kim loại và hiđro.
D. cả oxi, kim loại và hiđro.
Lời giải
Mức độ hoạt động mạnh hay yếu của phi kim căn cứ vào khả năng của phi kim đó phản ứng với cả oxi, kim loại và hiđro.
Đáp án: D
Bài 3: Để chuyển 11,2 gam Fe thành FeCl3 thì thể tích khí clo (đktc) cần dùng là
A. 6,72 lít.
B. 3,36 lít.
C. 4,48 lít.
D. 2,24 lít.
Lời giải
nFe = 0,2 mol
2Fe + 3Cl2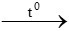 2FeCl3
2FeCl3
0,2 → 0,3 mol
=> V = 0,3.22,4 = 6,72 lít
Đáp án: A
Bài 4: Hỗn hợp khí X gồm O2, Cl2, CO2 SO2. Để thu được O2 tinh khiết, người ta dẫn X qua:
A. nước brom
B. dd NaOH
C. dd HCl
D. nước clo
Lời giải
Để thu được O2 tinh khiết, người ta dẫn X qua dung dịch NaOH vì Cl2, CO2 và SO2 đều có phản ứng
2NaOH + Cl2 → NaCl + NaClO + H2O
CO2 + 2NaOH → Na2CO3 + H2O
SO2 + 2NaOH → Na2SO3 + H2O
Đáp án: B
Bài 5: Để phân biệt SO2 và SO3 có thể dùng một hóa chất sau:
A. dd BaCl2
B. dd NaOH
C. dd H2SO4
D. dd Ba(OH)2
Lời giải
Để phân biệt SO2 và SO3 có thể dùng dung dịch BaCl2. SO2 không hiện tượng còn SO3 tạo kết tủa trắng
SO3 + H2O → H2SO4
H2SO4 + BaCl2 → BaSO4↓ + 2HCl
Đáp án: A
Bài 6: Cho 10,8 gam kim loại M hóa trị III tác dụng với khí clo dư thì thu được 53,4 gam muối. Hãy xác định kim loại M?
A. Fe B. Cr
C. Al D. Mg
Lời giải
2M + 3Cl2 → 2MCl3
Theo PT: 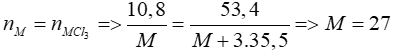
=> M là Al
Đáp án: C
Bài 7: X là nguyên tố phi kim có hóa trị III trong hợp chất với hiđro. Biết thành phần phần trăm khối lượng của hiđro trong hợp chất là 17,65%. X là nguyên tố:
A. C B. N
C. S D. P
Lời giải
Gọi phi kim cần tìm là X
=> hợp chất hiđro của X là: XH3
Ta có: phần trăm khối lượng của hiđro trong hợp chất là 17,65%
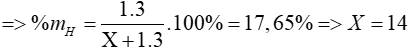
=> X là nguyên tố N
Đáp án: B
Bài 8: Hỗn hợp X gồm Zn, Mg và Fe. Hòa tan hết m gam X vào dung dịch HCl thu được 11,20 lít khí (đktc). Mặt khác, để tác dụng vừa hết m gam X cần 12,32 lít clo (đktc). Khối lượng của Fe trong hỗn hợp là
A. 2,8 gam
B. 5,6 gam
C. 8,4 gam
D. 11,2 gam
Lời giải
Gọi số mol của Zn, Mg và Fe lần lượt là x, y và z mol
TN1: tác dụng với dung dịch HCl tạo 0,5 mol khí H2
Zn + 2HCl → ZnCl2 + H2
x mol → x mol
Mg + 2HCl → MgCl2 + H2
y mol → y mol
Fe + 2HCl → FeCl2 + H2
z mol → z mol
⇒∑nH2 = x + y + z = 0,5 (1)
TN2: tác dụng với 0,55 mol Cl2
Zn + Cl2 → ZnCl2
x → x
Mg + Cl2 → MgCl2
y → y
2Fe + 3Cl2 → 2FeCl3
z → 1,5z
⇒∑nCl2 = x + y + 1,5z = 0,55 (2)
Lấy (2) trừ (1) => 0,5z = 0,55 – 0,5 => z = 0,1 mol
=> mFe = 0,1.56 = 5,6 gam
Đáp án: B
Bài 9: Dãy các nguyên tố được sắp xếp đúng theo chiều tính phi kim tăng dần:
A. O,F, P.
B. P, O, F.
C. F, O, P.
D. O, P, F.
Lời giải
Tính phi kim: P < O < F
Đáp án: B
Bài 10: Ở điều kiện thường, phi kim có thể tồn tại ở trạng thái
A. Lỏng và khí
B. Rắn và lỏng
C. Rắn và khí
D. Rắn, lỏng, khí
Lời giải
Ở điều kiện thường, phi kim có thể tồn tại ở trạng thái rắn, lỏng, khí
Đáp án: D
Bài 11: Dãy gồm các phi kim thể khí ở điều kiện thường
A. S, P, N2, Cl2
B. C, S, Br2, Cl2
C. Cl2, H2, N2, O2
D. Br2, Cl2, N2, O2
Lời giải
Dãy gồm các phi kim thể khí ở điều kiện thường là: Cl2, H2, N2, O2
Loại A vì S ở thể rắn
Loại B và D vì Br2 ở thể lỏng
Đáp án: C
Bài 12: Dãy gồm các nguyên tố phi kim là
A. C, S, O, Fe
B. Cl, C, P, S
C. P, S, Si, Ca
D. K, N, P, Si
Lời giải
Dãy gồm các nguyên tố phi kim là Cl, C, P, S
Đáp án: B
Bài 13: Dãy phi kim tác dụng với oxi tạo thành oxit là
A. S, C, P
B. S, C, Cl2
C. C, P, Br2
D. C, Cl2, Br2
Lời giải
Dãy phi kim tác dụng với oxi tạo thành oxit là S, C, P
S + O2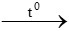 SO2
SO2
C + O2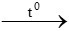 CO2
CO2
4P + 5O2 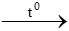 2P2O5
2P2O5
Loại B, C và D vì Cl2 và Br2 không phản ứng với O2
Đáp án: A
Câu 14: Cho 6,6 gam CO2 đi qua 200ml dung dịch KOH 1M. Sau phản ứng kết thúc, thu được những sản phẩm muối nào?
A. Muối trung hòa K2CO3
B. Muối axit KHCO3
C. Cả hai loại muối
D. Không xác định được
Đáp án: C
Câu 15: Hỗn hợp gồm các khí: CO, CO2, SO3 có thể nhận biết sự hiện diện các chất khí bằng cách:
A. Dẫn hỗn hợp qua dung dịch BaCl2
B. Dẫn hỗn hợp qua dung dịch BaCl2, sau đó qua dung dịch nước vôi trong.
C. Dẫn hỗn hợp qua dung dịch nước vôi trong.
D. Tất cả đều đúng.
Đáp án: B
Câu 16: Cho a mol P2O5 vào dung dịch chứa 0,015 mol NaOH. Dung dịch sau phản ứng chứa 2 muối NaH2PO4 và Na2HPO4 với số mol bằng nhau. Gái trị của a là:
A. 0,010
B. 0,015
C. 0,005
D.0,002
Đáp án: C
Câu 17: Hỗn hợp khí X gồm O2 Cl2, CO2 SO2. Để thu được O2 tinh khiết, người ta dẫn X qua:
A. nước brom
B. dd NaOH
C. dd HCl
D. nước clo
Đáp án: B
Câu 18: Có 4 lọ đựng 4 khí riêng biệt: oxi, hidro, clo và khí cacbonic. Bằng cách nào trong các cách sau đây để phân biệt mỗi khí trên (tiến hành theo trình tự sau);
A. Dùng nước vôi trong dư
B. Dùng nước vôi trong dư, dùng quỳ tím ấm
C. Dùng tàn đom đóm, dùng quỳ tím ẩm
D. Dùng quỳ tím ẩm, dùng nước vôi trong
Đáp án: C
Câu 19: Sản phẩm của phản ứng khi đốt cháy hoàn toàn lần lượt lưu huỳnh, hiđro, cacbon, photpho, trong khí oxi dư là :
A. SO2 , H2O, CO2 , P2O5
B. SO3 , H2O, CO2 , P2O5
C. SO2 , H2O, CO , P2O5
D. SO3 , H2O, CO , P2O5
Đáp án: A
Câu 20: Cho sơ đồ biến đổi sau: Phi kim → Oxit axit (1) → Oxit axit (2) → Axit
Dãy chất phù hợp với sơ đồ trên là:
A. S → SO2 →SO3 → H2SO4
B. C → CO → CO2 → H2CO3
C. P →P2O3 → P2O5 →H3PO3
D. N2 → NO →N2O5 →HNO3
Đáp án: A