Tailieumoi.vn giới thiệu Giải bài tập Hóa học 9 Bài 25. Tính chất của phi kim chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Tính chất của phi kim lớp 9.
Giải bài tập Hóa học 9 Bài 25. Tính chất của phi kim
Bài 1 trang 76 SGK Hóa học 9: Hãy chọn câu đúng :
A. Phi kim dẫn điện tốt.
B. Phi kim dẫn nhiệt tốt.
C. Phi kim chỉ tồn tại ở hai trạng thái rắn, khí.
D. Phi kim dẫn điện, dẫn nhiệt kém.
Lời giải:
A. sai, phi kim dẫn điện kém
B. sai, phi kim dẫn nhiệt kém
C. sai, phi kim tồn tại ở cả ba trạng thái: rắn, lỏng và khí
D. đúng.
Đáp án D
Bài 2 trang 76 SGK Hóa học 9: Viết các phương trình hoá học của S, C, Cu, Zn với khí O2. Cho biết các oxit tạo thành thuộc loại nào. Viết công thức các axit hoặc bazơ tương ứng với mỗi oxit đó.Lời giải:
(1) S + O2 SO2;
SO2 là oxit axit, có axit tương ứng là H2SO3
(2) C+ O2 CO2
CO2 là oxit axit, có axit tương ứng là H2CO3
(3) 2Cu + O2 2CuO;
CuO là oxit bazơ, có bazơ tương ứng là Cu(OH)2
(4) 2Zn + O2 2ZnO
ZnO là oxit lưỡng tính, có bazơ tương ứng là Zn(OH)2 và axit tương ứng là H2ZnO2
Bài 3 trang 76 SGK Hóa học 9: Viết các phương trình hoá học và ghi đầy đủ điều kiện khi cho hiđro phản ứng với:
a) clo ; b) lưu huỳnh ; c) brom.
Cho biết trạng thái của các chất tạo thành.
Lời giải:
a) H2(k) + Cl2(k) 2HCl (k) (HCl là chất khí, không màu)
b) H2 (k) + S (r) H2S (k) (khí H2S có mùi trứng thối)
c) H2(k)+ Br2(l) 2HBr (k) (HBr là chất khí, không màu)
Bài 4 trang 76 SGK Hóa học 9: Viết các phương trình hoá học giữa các cặp chất sau đây (ghi rõ điều kiện, nếu có):a) khí flo và hiđro;
b) lưu huỳnh và oxi;
c) bột sắt và bột lưu huỳnh;
d) cacbon và oxi;
e) khí hiđro và lưu huỳnh.
Lời giải:
Các phương trình hóa học của phản ứng giữa:
a) Khí flo và hidro: F2 + H2 -> 2HF (phản ứng xảy ra trong bóng tối và nổ mạnh)
b) Lưu huỳnh và oxi: S + O2 SO2
c) Bột sắt và bột lưu huỳnh: S + Fe FeS
d) Cacbon và oxi: C + O2 CO2
e) Khí hidro và lưu huỳnh: H2 + S H2S
Bài 5 trang 76 SGK Hóa học 9: Cho sơ đồ biểu diễn chuyển đổi sau:Phi kim oxit axit oxit axit axit muối suntat tan muối sunfat không tan
a) Tìm công thức các chất thích hợp để thay cho tên chất trong sơ đồ.
b) Viết các phương trình hoá học biểu diễn chuyển đổi trên.
Lời giải:
a)
b) Các phương trình hóa học:
Bài 6 trang 76 SGK Hóa học 9: Nung hỗn hợp gồm 5,6 gam sắt và 1,6 gam lưu huỳnh trong môi trường không có không khí. Sau phản ứng thu được hỗn hợp chất rắn A. Cho dung dịch HCl 1M phản ứng vừa đủ với A thu đuợc hỗn hợp khí B.
a) Hãy viết các phương trình hoá học.
b) Tính thể tích dung dịch HCl 1M đã tham gia phản ứng.
Phương pháp giải:
- Tính số mol của sắt và lưu huỳnh.
- Viết phương trình hóa học: Fe + S FeS
So sánh: nFe/1 và nS/1, tỉ số nào nhỏ hơn thì lượng chất được tính theo chất đó.
- Đặt số mol vào PTHH, tính toán theo PTHH.
Lời giải:
a. PTHH: (1)
Ta thấy Fe dư, S phản ứng hết. mọi tính toán tính theo số mol của S
Theo phương trình (1):
Theo phương trình (1):
Vậy chất rắn A gồm Fe dư (0,05 mol) và FeS (0,05 mol)
b. Khi cho chất rắn A tác dụng với dung dịch HCl ta có các phương trình hóa học:
(2)
(3)
Theo phương trình (2):
Theo phương trình (3):
lít
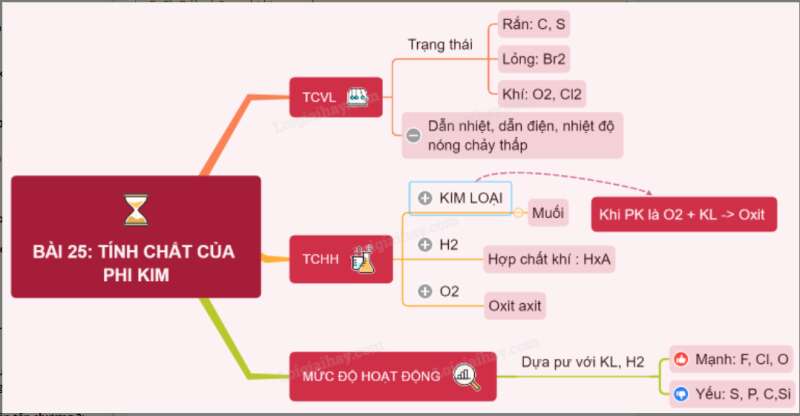
I. Tính chất vật lí
- Phi kim có thể tồn tại ở 3 trạng thái:
+ Thể rắn: I2, S, C,…
+ Thể lỏng: Br2
+ Thể khí: O2, N2, Cl2,…
II. Tính chất hóa học
1. Tác dụng với kim loại
- Nhiều phi kim tác dụng với kim loại tạo thành muối
Ví dụ:
+ Sắt cháy trong khí clo xuất hiện chất rắn màu nâu đỏ
PTHH: 2Fe + 3Cl2 2FeCl3
+ Đồng tác dụng với lưu huỳnh tạo hợp chất màu đen:
PTHH: Cu + S CuS
2. Tác dụng với hiđro
- Oxi tác dụng với khí hiđro tạo thành nước: 2H2 + O2 2H2O
- Hiđro cháy trong khí clo (màu vàng lục) tạo thành khí không màu làm giấy quỳ tím ẩm chuyển đỏ
PTHH: H2 + Cl2 2HCl
3. Tác dụng với oxi
- Nhiều phi kim tác dụng với oxi tạo thành oxit axit
Svàng + O2 SO2 không màu
4Pđỏ + 5O2 2P2O5 trắng
4. Mức độ hoạt động của phi kim
- Mức độ hoạt động hóa học mạnh hay yếu của phi kim được xét căn cứ vào khả năng và mức độ phản ứng của ohi kim đó với kim loại và hiđro.
Ví dụ:
+ F, Cl, O là những phi kim mạnh
+ S, P, C, Si là những phi kim yếu
Sơ đồ tư duy: Tính chất của phi kim