Bộ 10 đề thi Hóa học lớp 12 học kì 2 năm 2022 tải nhiều nhất tổng hợp từ đề thi môn Hóa học 12 của các trường THPT trên cả nước đã được biên soạn đáp án chi tiết giúp học sinh ôn luyện để đạt điểm cao trong bài thi học kì 2 Hóa học lớp 12. Mời các bạn cùng đón xem:
Bộ 10 đề thi Hóa học lớp 12 học kì 2 năm 2022 tải nhiều nhất – Đề 1
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 12
Thời gian làm bài: 45 phút
(Đề thi số 1)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh:..................................................................... Lớp: .............................
Cho nguyên tử khối của các nguyên tố: F = 19; Cl = 35,5; Br = 80; I = 127; Ag = 108; Li = 7; Na = 23; K = 39; Be = 9; Mg = 12; Ca = 40; Ba = 137; Al = 27; Fe = 56; Cr = 52; Cu = 64; Zn = 65; Mg = 24; O = 16; S = 32.
Câu 1: Trong dung dịch CuSO4, ion Cu2+ không bị khử bởi kim loại
A. Fe. B. Ag.
C. Mg. D. Zn.
Câu 2: Cho sơ đồ:
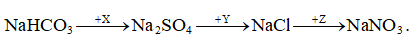
. X, Y và Z tương ứng là
A. NaHSO4, BaCl2, AgNO3.
B. H2SO4, BaCl2, HNO3.
C. K2SO4, HCl, AgNO3.
D. (NH4)2SO4, HCl, HNO3.
Câu 3: Có 4 dung dịch riêng biệt: CuSO4, ZnCl2, FeCl3 và AgNO3. Nhúng vào mỗi dung dịch một thanh Ni. Số trường hợp xuất hiện ăn mòn điện hoá là
A. 2 B. 1
C. 4 D. 3
Câu 4: Cho FeCl2 vào dung dịch AgNO3 dư thu được chất rắn X. Cho X vào dung dịch HNO3 dư thu được dung dịch Y. Giả thiết các phản ứng xảy ra hoàn toàn. Nhận xét nào sau đây đúng?
A. X là Ag.
B. Y chứa một chất rắn.
C. X tan hết trong dung dịch HNO3.
D. X không tan hết trong dung dịch HNO3.
Câu 5: Chọn phát biểu sai:
A. Cr2O3 là chất rắn màu lục đậm.
B. Cr(OH)3 là chất rắn màu xanh lục.
C. CrO3 là chất rắn màu đỏ thẫm.
D. CrO là chất rắn màu trắng xanh.
Câu 6: Quặng sắt manhetit có thành phần là
A. FeS2. B. Fe3O4.
C. FeCO3. D. Fe2O3.
Câu 7: Chất rắn X là hợp chất của crom, khi cho vào dung dịch Ba(OH)2 dư tạo kết tủa màu vàng. X không phải chất nào dưới đây?
A. CrO3. B. Na2CrO4.
C. K2Cr2O7. D. Cr(OH)3.
Câu 8: Tìm phản ứng chứng minh hợp chất sắt (II) có tính khử?
A. FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl.
B. Fe(OH)2 + 2HCl → FeCl2 + 2H2O.
C. 3FeO + 10HNO3 → 3Fe(NO3)3 + 5H2O + NO.
D. Fe + 2HCl → FeCl2 + H2.
Câu 9: Dung dịch HCl, H2SO4 loãng nóng sẽ oxi hóa crom đến mức oxi hóa nào?
A. +2. B. +3.
C. +4. D. +6.
Câu 10: Kim loại đồng không tan trong dung dịch nào sau đây?
A. H2SO4 đặc, nóng.
B. FeCl3.
C. HCl.
D. hỗn hợp NaNO3 và HCl.
Câu 11: Cho luồng khí CO dư đi qua 5,64 gam hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 rồi nung nóng. Khí sinh ra sau phản ứng cho qua dung dịch nước vôi trong dư có 8 gam kết tủa. Khối lượng Fe thu được sau phản ứng là
A. 4,63g.
B. 4,0g.
C. 4,36g.
D. 4,2g.
Câu 12: Đốt 1 lượng nhôm trong 6,72 lít O2. Chất rắn thu được sau phản ứng cho hoà tan hoàn toàn vào dung dịch NaOH thấy bay ra 6,72 lít H2 (các thể tích khí đo ở đkc). Khối lượng nhôm đã dùng là
A. 18,4 gam. B. 8,1 gam.
C. 24,3 gam D. 16,2 gam.
Câu 13: Hòa tan hết 4,6 gam Na trong 100 ml dung dịch HCl 0,5M thu được H2 và dung dịch X. Cô cạn X được số gam rắn là
A. 10,2 gam. B. 8,925 gam.
C. 8 gam. D. 11,7 gam.
Câu 14: Hợp chất nào của canxi nào sau đây không gặp trong tự nhiên?
A. CaCO3. B. CaSO4.
C. Ca(HCO3)2. D. CaO.
Câu 15: Dung dịch loãng X chứa 8,82 gam H2SO4 và 10,152 gam Cu(NO3)2. Thêm m gam bột sắt vào dung dịch X, sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y, một kim loại có khối lượng là 0,5m gam và chỉ tạo khí NO (sản phẩm khử duy nhất của N+5). Giá trị của m là
A. 6,696. B. 9,216.
C. 6,45. D. 6,72.
Câu 16: Tiến hành các thí nghiệm sau:
(1) Cho Mg tác dụng với dung dịch HNO3 loãng dư.
(2) Cho dung dịch NaOH vào dung dịch amôni glucônat
(3) Cho dung dịch KHSO4 vào dung dịch NaHCO3.
(4) Cho Cu vào dung dịch H2SO4 loãng
(5) Cho từ từ Na2CO3 vào dung dịch HCl
Số thí nghiệm chắc chắn sinh ra chất khí là
A. 4. B. 2.
C. 3. D. 1.
Câu 17: Cho 1,62 gam nhôm vào 100 ml dung dịch chứa CuSO4 0,6M và Fe2(SO4)3 xM. Kết thúc phản ứng thu được 4,96 gam chất rắn gồm 2 kim loại. Giá trị của x là
A. 0,25. B. 0,1.
C. 0,15. D. 0,2.
Câu 18: Phản ứng hóa học nào sau đây là sai?
A. 2Fe + 3Cl2 2FeCl3.
B. 2Cr + 3Cl2 2CrCl3.
C. Fe + 2HCl (loãng) → FeCl2 + H2.
D. 2Cr + 6HCl 2CrCl3 + 3H2.
Câu 19: Nhận định nào sau đây là sai?
A. Kim loại natri, kali tác dụng được với nước ở điều kiện thường.
B. Sục khí CO2 vào dung dịch natri aluminat, thấy xuất hiện kết tủa keo trắng.
C. Sắt là kim loại nhẹ, có tính dẫn điện, dẫn nhiệt tốt, đặc biệt có tính nhiễm từ.
D. Nhôm tác dụng được với dung dịch natri hiđroxit.
Câu 20: Kim loại M phản ứng được với: dung dịch HCl, dung dịch AgNO3, dung dịch HNO3 (đặc, nguội). Kim loại M là
A. Fe. B. Zn. C. Cu. D. Al.
Câu 21: Cho 8,16 gam hỗn hợp X gồm Fe, FeO, Fe3O4 và Fe2O3 phản ứng hết với dung dịch HNO3 loãng (dung dịch Y), thu được 1,344 lít NO (đktc) và dung dịch Z. Dung dịch Z hòa tan tối đa 5,04 gam Fe, sinh ra khí NO. Biết trong các phản ứng, NO là sản phẩm khử duy nhất của N+5. Số mol HNO3 có trong Y là
A. 0,78 mol. B. 0,54 mol.
C. 0,50 mol. D. 0,44 mol.
Câu 22: Một lá sắt có khối lượng m gam nhúng vào dung dịch CuSO4. Kết thúc phản ứng thấy khối lượng lá sắt bằng (m + 2,4) gam. Khối lượng Cu do phản ứng sinh ra bám lên lá sắt là
A. 12,8 gam. B. 9,6 gam.
C. 16 gam. D. 19,2 gam.
Câu 23: Cho 8,28 gam hỗn hợp gồm Al và Al2O3 vào 560 ml dung dịch HCl 1,25M thu được 2,688 lít khí H2 (đktc) và dung dịch X. Cho từ từ 740 ml dung dịch NaOH 1M vào dung dịch X, thu được m gam kết tủa. Các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 12,48 gam. B. 15,60 gam.
C. 11,70 gam. D. 14,04 gam.
Câu 24: Kim loại nào sau đây tan hết trong nước dư ở nhiệt độ thường?
A. Na. B. Fe.
C. Mg. D. Al.
Câu 25: Hỗn hợp X chứa Mg, Fe3O4 và Cu (trong đó oxi chiếm 16% về khối lượng). Cho m gam hỗn hợp X vào dung dịch chứa 2,1 mol HNO3 (lấy dư 25% so với phản ứng) thu được dung dịch Y và 0,16 mol khí NO. Cô cạn dung dịch Y thu được 3,73m gam muối khan. Giá trị của m gần nhất với giá trị nào sau đây?
A. 30 gam. B. 35 gam.
C. 40 gam. D. 25 gam.
Câu 26: Cho hỗn hợp gồm Fe2O3 (2a mol) và Cu (a mol) vào dung dịch chứa 12a mol HCl, thu được dung dịch X. Điều khẳng định nào sau đây là đúng?
A. Cho NaNO3 vào dung dịch X, sau đó cho tiếp bột Cu vào thấy khí NO thoát ra.
B. Nhúng thanh Fe vào X, kết thúc phản ứng, khối lượng thanh Fe tăng so với khối lượng ban đầu.
C. Cho lượng dư dung dịch AgNO3 vào X, thu được một loại kết tủa duy nhất.
D. Cho lượng dư dung dịch NaOH vào X, thu được 3 loại kết tủa.
Câu 27: Trên thế giới, rất nhiều người mắc các bệnh về phổi bởi chứng nghiện thuốc lá. Nguyên nhân chính là do trong trong khói thuốc lá có chứa chất
A. nicotin. B. aspirin.
C. cafetin. D. moocphin.
Câu 28: Thực hiện các thí nghiệm sau:
(a) Cho Al vào dung dịch HCl.
(b) Cho Al vào dung dịch AgNO3.
(c) Cho Na vào H2O.
(d) Cho Ag vào dung dịch H2SO4 loãng.
Trong các thí nghiệm trên, số thí nghiệm xảy ra phản ứng là
A. 3. B. 4.
C. 1. D. 2.
Câu 29: Một loại nước cứng khi đun sôi thì mất tính cứng. Trong loại nước cứng này có hòa tan những hợp chất nào sau đây?
A. Ca(HCO3)2, Mg(HCO3)2
B. Mg(HCO3)2, CaCl2
C. CaSO4, MgCl2
D. Ca(HCO3)2, MgCl2
Câu 30. Cho hỗn hợp Cu và Fe2O3 vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch X và một lượng chất rắn không tan. Muối trong dung dịch X là
A. FeCl3.
B. CuCl2, FeCl2.
C. FeCl2, FeCl3.
D. FeCl2.
Bộ 10 đề thi Hóa học lớp 12 học kì 2 năm 2022 tải nhiều nhất – Đề 2
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 12
Thời gian làm bài: 45 phút
(Đề thi số 2)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh:..................................................................... Lớp: .............................
Cho nguyên tử khối của các nguyên tố: F = 19; Cl = 35,5; Br = 80; I = 127; Ag = 108; Li = 7; Na = 23; K = 39; Be = 9; Mg = 12; Ca = 40; Ba = 137; Al = 27; Fe = 56; Cr = 52; Cu = 64; Zn = 65; Mg = 24; O = 16; S = 32.
Câu 1: Cho sơ đồ phản ứng:
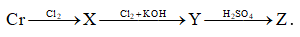
X, Y, Z lần lượt là
A. CrCl3, K2CrO4, K2Cr2O7.
B. CrCl3, K2Cr2O7, K2CrO4.
C. CrCl2, K2CrO4, K2Cr2O7.
D. CrCl2, K2Cr2O7, K2CrO4.
Câu 2: Ở điều kiện thường, kim loại nào sau đây không phản ứng với nước?
A. Na. B. Ba.
C. Be. D. K.
Câu 3: Cho 1,37 gam Ba vào 1 lít dung dịch CuSO4 0,01M. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng kết tủa thu được là
A. 3,31g. B. 1,71g.
C. 2,33g. D. 0,98g.
Câu 4: Hòa tan hỗn hợp gồm K2O, BaO, Al2O3 và Fe3O4 vào nước dư, thu được dung dịch X và chất rắn Y. Sục khí CO2 đến dư vào dung dịch X, sau khi các phản ứng xảy ra hoàn toàn thu được kết tủa là
A. K2CO3. B. Fe(OH)3.
C. Al(OH)3. D. BaCO3.
Câu 5: Cặp chất nào sau đây cùng tồn tại trong một dung dịch?
A. AgNO3 và Fe(NO3)2.
B. Ca(HCO3)2 và NaHSO4.
C. NaHCO3và BaCl2.
D. NaHSO4 và NaHCO3.
Câu 6: Cho m gam Fe vào dung dịch chứa 0,3 mol AgNO3 và 0,1 mol Cu(NO3)2. Sau khi các phản ứng xảy ra hoàn toàn, thu được 5,4m gam chất rắn. Giá trị của m gần nhất với
A. 9,0.
B. 5,64.
C. 6,12.
D. 9,5.
Câu 7: Cho phản ứng hóa học: FeS + HNO3 → Fe(NO3)3 + H2SO4 + NO + NO2 + H2O. Biết tỉ lệ số mol NO và NO2 là 3 : 4. Sau khi cân bằng phản ứng hóa học trên với hệ số các chất là những số nguyên tối giản thì hệ số của HNO3 là
A. 76.
B. 63.
C. 102.
D. 39.
Câu 8: Cho các phương trình ion rút gọn sau:
a) Cu2+ + Fe → Fe2+ + Cu
b) Cu + 2Fe3+ → 2Fe2+ + Cu2+
c) Fe2+ + Mg → Mg2+ + Fe
Nhận xét đúng là
A. Tính khử của: Mg > Fe > Fe2+ > Cu.
B. Tính khử của: Mg > Fe2+ > Cu > Fe.
C. Tính oxi hóa của: Cu2+ > Fe3+ > Fe2+ > Mg2+.
D. Tính oxi hóa của: Fe3+ > Cu2+ > Fe2+ > Mg2+.
Câu 9: Hòa tan hết 5,36 gam hỗn hợp X gồm FeO, Fe2O3, Fe3O4 trong dung dịch chứa 0,03 mol HNO3 và 0,12 mol H2SO4, thu được dung dịch Y và 224 ml NO (đktc). Cho 2,56 gam Cu vào Y, thu được dung dịch Z. Biết các phản ứng xảy ra hoàn toàn, NO là sản phẩm khử duy nhất của N+5. Khối lượng muối trong Z là
A. 19,424. B. 16,924.
C. 18,465. D. 23,176.
Câu 10: Hợp chất nào sau đây không có tính chất lưỡng tính?
A. ZnO. B. Zn(OH)2.
C. ZnSO4. D. Zn(HCO3)2.
Câu 11: Để loại tạp chất CuSO4 khỏi dung dịch FeSO4 để thu được dung dịch FeSO4 tinh khiết cần làm như thế nào?
A. Ngâm lá đồng vào dung dịch.
B. Cho AgNO3 vào dung dịch.
C. Ngâm lá kẽm vào dung dịch.
D. Ngâm lá sắt vào dung dịch.
Câu 12: Chọn phát biểu sai?
A. Cr2O3 là chất rắn màu lục thẫm.
B. Cr(OH)3 là chất rắn màu lục xám.
C. CrO3 là chất rắn màu đỏ thẫm.
D. Na2CrO4 là muối có màu da cam.
Câu 13: Hòa tan hết 15,12 gam hỗn hợp X gồm FeCO3 và Al2O3 cần dùng 600 ml dung dịch HCl 1M, thu được dung dịch Y. Cho 700 ml dung dịch NaOH 1M vào dung dịch Y, thu được m gam kết tủa. Giá trị của m là
A. 10,08 gam.
B. 17,88 gam.
C. 12,38 gam.
D. 14,68 gam.
Câu 14: Cho các thí nghiệm sau:
(1) Cho Cu vào dung dịch FeCl3;
(2) H2S vào dung dịch CuSO4;
(3) HI vào dung dịch FeCl3;
(4) Dung dịch AgNO3 vào dung dịch FeCl3;
(5) Dung dịch NaHSO4 vào dung dịch Fe(NO3)2;
(6) CuS vào dung dịch HCl.
Số cặp chất phản ứng được với nhau là
A. 2. B. 4.
C. 5. D. 3.
Câu 15: Trộn bột kim loại X với bột sắt oxit (gọi là hỗn hợp tecmit) để thực hiện phản ứng nhiệt nhôm dùng để hàn đường ray tàu hỏa. Kim loại X là?
A. Fe. B. Cu.
C. Ag. D. Al.
Câu 16: Thí nghiệm nào sau đây không tạo ra đơn chất?
A. Cho Na vào dung dịch CuSO4.
B. Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3.
C. Cho bột Fe vào lượng dư dung dịch FeCl3.
D. Cho bột Al vào lượng dư dung dịch CuCl2.
Câu 17: Hòa tan oxit MO bằng dung dịch H2SO4 24,5% vừa đủ thu được dung dịch MSO4 có nồng độ 33,33%. Oxit kim loại đã dùng là
A. ZnO. B. CaO.
C. MgO. D. CuO.
Câu 18: Cho các phát biểu sau:
(a) Khi tác dụng với cacbon ở nhiệt độ cao, Al bị khử thành Al+3.
(b) Khi cho Al tác dụng với dung dịch kiềm, chất oxi hoá là OH-.
(c) Cho Al vào dung dịch CuCl2, xảy ra sự ăn mòn điện hoá học
(d) Khi đốt nóng, bột nhôm cháy sáng trong không khí.
Số phát biểu đúng là
A. 1. B. 2.
C. 3. D. 4.
Câu 19: Điện phân 400ml dung dịch AgNO3 0,2M và Cu(NO3)2 0,1M với cường độ dòng điện I = 10A, anot bằng Pt. Sau thời gian t ngắt dòng điện, thấy khối lượng catot tăng thêm m gam trong đó có 1,28 gam Cu. Thời gian điện phân t là (hiệu suất điện phân là 100%)
A. 116 s. B. 1158 s.
C. 772 s. D. 193 s.
Câu 20: Cho 5,36 gam hỗn hợp X gồm FeO, Fe2O3 và Fe3O4 tác dụng với dung dịch HCl dư thu được dung dịch có chứa 3,81 gam FeCl2. Cho Y thu được tác dụng với lượng dư dung dịch AgNO3 được V lít NO (sản phẩm khử duy nhất của N+5, đktc) và 30,32 gam kết tủa. Các phản ứng xảy ra hoàn toàn. Giá trị của V là
A. 0,672. B. 0,1344.
C. 0,112. D. 0,224.
Câu 21: Cho hỗn hợp bột gồm Fe và Cu vào dung dịch FeCl3, sau khi phản ứng xong còn lại chất rắn, chất rắn này tác dụng dung dịch HCl sinh ra khí H2. Dung dịch thu được từ thí nghiệm trên chứa
A. muối FeCl2 duy nhất.
B. muối FeCl2 và CuCl2.
C. hỗn hợp muối FeCl2 và FeCl3.
D. hỗn hợp muối FeCl3 và CuCl2.
Câu 22: Cho Cu tác dụng với dung dịch chứa H2SO4 loãng và NaNO3, vai trò của NaNO3 trong phản ứng là
A. chất xúc tác.
B. chất oxi hóa.
C. môi trường.
D. chất khử.
Câu 23: Hòa tan 12,8 gam hỗn hợp gồm MgO, Ca bằng dung dịch HCl vừa đủ. Sau phản ứng thu được dung dịch A và V lít khí H2. Cho AgNO3 dư vào dung dịch A thu được m gam kết tủa. Giá trị của m là
A. 91,84 gam.
B. 45,92 gam.
C. 40,18 gam.
D. 83,36 gam.
Câu 24: Nung bột Fe2O3 với a gam bột Al trong khí trơ, thu được 11,78 gam hỗn hợp rắn X. Cho toàn bộ X vào lượng dư dung dịch NaOH, thu được 1,344 lít H2 (đktc). Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của a là
A. 1,95. B. 3,78.
C. 2,43. D. 2,56.
Câu 25: Hòa tan hết 20,0 gam hỗn hợp X gồm Cu và các oxit sắt (trong hỗn hợp X oxi chiếm 16,8% về khối lượng) bằng dung dịch A chứa hỗn hợp b mol HCl và 0,2 mol HNO3 (vừa đủ) thu được 1,344 lít NO (đktc, là sản phẩm khử duy nhất của N+5) và dung dịch Y. Cho dung dịch Y tác dụng với một lượng vừa đủ dung dịch AgNO3 thu được m gam kết tủa và dung dịch Z. Cho dung dịch Z tác dụng với một lượng dư dung dịch NaOH, lọc kết tủa, nung đến khối lượng không đổi thu được 22,4 gam chất rắn. Các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 83,29. B. 76,81.
C. 70,33. D. 78,97.
Câu 26: Nhúng thanh Mg vào 200 ml dung dịch chứa HCl 0,7M và FeCl3 0,6M. Sau khi kết thúc phản ứng thu được dung dịch X. Giả sử thể tích không đổi, nồng độ mol/l của MgCl2 trong dung dịch X là
A. 0,65. B. 0,85.
C. 1,25. D. 1,05.
Câu 27: Hòa tan hoàn toàn hỗn hợp X gồm BaO, NH4HCO3, NaHCO3 (có tỷ lệ mol lần lượt là 5 : 4 : 2) vào nước dư, đun nóng. Đến khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chứa
A. NaHCO3 và Ba(HCO3)2
B. Na2CO3.
C. NaHCO3.
D. NaHCO3 và (NH4)2CO3.
Câu 28: Trong không khí ẩm, các vật dụng bằng đồng bị bao phủ bởi lớp gỉ màu xanh. Lớp gỉ đồng là
A. (CuOH)2.CuCO3.
B. CuCO3.
C. Cu2O.
D. CuO.
Câu 29: Thực hiện các thí nghiệm sau ở nhiệt độ thường:
(a) Cho bột Al vào dung dịch NaOH.
(b) Cho bột Fe vào dung dịch AgNO3.
(c) Cho CaO vào nước.
(d) Cho dung dịch Na2CO3 vào dung dịch CaCl2.
Số thí nghiệm có xảy ra phản ứng là
A. 4. B. 2.
C. 3. D. 1.
Câu 30: Khử hoàn toàn 32 gam CuO bằng khí CO dư, thu được m gam kim loại. Giá trị của m là
A. 25,6.
B. 19,2.
C. 6,4.
D. 12,8.
Bộ 10 đề thi Hóa học lớp 12 học kì 2 năm 2022 tải nhiều nhất – Đề 3
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 12
Thời gian làm bài: 45 phút
(Đề thi số 3)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh:..................................................................... Lớp: .............................
Cho nguyên tử khối của các nguyên tố: F = 19; Cl = 35,5; Br = 80; I = 127; Ag = 108; Li = 7; Na = 23; K = 39; Be = 9; Mg = 12; Ca = 40; Ba = 137; Al = 27; Fe = 56; Cr = 52; Cu = 64; Zn = 65; Mg = 24; O = 16; S = 32.
Câu 1: Cho 7,8 g Zn vào 200 ml dung dịch Fe2(SO4)3 0,45 M kết thúc phản ứng, thu được chất rắn có khối lượng là
A. 4,48g. B. 1,68g.
C. 1,95g. D. 2,8g.
Câu 2: Cho 2,24 gam bột sắt vào 200 ml dung dịch chứa hỗn hợp gồm AgNO3 0,1M và Cu(NO3)2 0,5M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y. Giá trị của m là
A. 2,80. B. 2,16.
C. 4,08. D. 0,64.
Câu 3: Hoà tan hoàn toàn 0,15 mol phèn chua vào nước thu được dung dịch X. Cho X tác dụng với 200 ml dung dịch gồm Ba(OH)2 1M và NaOH 1M, sau phản ứng thu được m gam kết tủa. Giá trị m là
A. 54,4. B. 23,3.
C. 46,6. D. 58,3.
Câu 4: Cho 27,84 gam FexOy tác dụng CO dư, nung nóng đến phản ứng hoàn toàn, cho toàn bộ khí sau phản ứng vào dung dịch Ca(OH)2 dư được 48 gam kết tủa. Công thức oxit sắt là
A. Không đủ dữ liệu.
B. Fe3O4.
C. FeO.
D. Fe2O3.
Câu 5: Thực hiện phản ứng giữa các cặp chất sau:
1. Fe2O3 + HNO3 →
2. FeCl3 + Fe →
3. Fe2(SO4)3 + Cu →
4. Al + Fe2O3 →
Các phản ứng xảy ra mà trong đó hợp chất sắt(III) thể hiện tính oxi hóa là
A. 1, 2, 4. B. 2, 3, 4.
C. 1, 2, 3. D. 1, 3, 4.
Câu 6: Cho dãy các chất: AlCl3, NaHCO3, Al(OH)3, Na2CO3, Al. Số chất trong dãy đều tác dụng được với axit HCl, dung dịch NaOH là
A. 2. B. 5.
C. 4. D. 3.
Câu 7: Ion Na+ bị khử trong trường hợp nào sau đây?
1) Điên phân dung dịch NaCl có màng ngăn.
2) Dùng khí CO khử Na2O ở nhiệt độ cao.
3) Điện phân NaCl nóng chảy.
4) Cho khí HCl tác dụng với NaOH.
A. 2, 3. B. 1, 3.
C. 1, 3, 4. D. 3.
Câu 8: Khi cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 thấy có hiện tượng
A. kết tủa trắng xuất hiện.
B. bọt khí và kết tủa trắng.
C. kết tủa trắng sau đó kết tủa tan dần.
D. bọt khí bay ra.
Câu 9: Cho dãy các kim loại: Fe, Na, K, Ca. Số kim loại trong dãy tác dụng được với nước ở nhiệt độ thường là
A. 4. B. 3.
C. 2. D. 1.
Câu 10: Để tách Ag ra khỏi hỗn hợp A gồm Ag, Cu, Fe mà không làm thay đổi khối lượng Ag ta dùng dung dịch nào sau đây?
A. NaOH dư. B. AgNO3 dư.
C. FeCl3 dư. D. HCl dư.
Câu 11: Các quá trình sau:
- Cho dung dịch AlCl3 tác dụng với dung dịch NH3 dư.
- Cho dung dịch Ba(OH)2 dư vào dung dịch Al2(SO4)3.
- Cho dung dịch HCl dư vào dung dịch NaAlO2.
- Dẫn khí CO2 dư vào dung dịch NaAlO2.
Số quá trình thu được kết tủa là
A. 3. B. 2.
C. 1. D. 4.
Câu 12: Cho các hợp kim sau: Cu - Fe (I), Zn - Fe (II), Fe - C (III), Sn - Fe (IV). Khi tiếp xúc với dung dịch chất điện li thì các hợp kim mà trong đó Fe đều bị ăn mòn trước là
A. I, III và IV.
B. I, II và III.
C. I, II và IV.
D. II, III và IV.
Câu 13: Cho một lá sắt vào dung dịch chứa một trong những muối sau: ZnCl2 (1), CuSO4 (2), Pb(NO3)2 (3), NaNO3 (4), MgCl2 (5), AgNO3 (6). Số trường hợp xảy ra phản ứng là
A. 5. B. 3.
C. 2. D. 4.
Câu 14: Cho luồng khí H2 (dư) qua hỗn hợp các oxit CuO, Fe2O3, MgO nung ở nhiệt độ cao. Sau phản ứng hỗn hợp rắn còn lại là
A. CuO, Fe, MgO.
B. Cu, FeO, MgO.
C. Cu, Fe, MgO.
D. Cu, Fe, Mg.
Câu 15: Hai dung dịch đều phản ứng được với kim loại Fe là
A. CuSO4 và HCl.
B. ZnCl2 và FeCl3.
C. CuSO4 và ZnCl2.
D. HCl và AlCl3.
Câu 16: Cho phản ứng hoá học: Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng trên xảy ra
A. sự khử Fe2+ và sự khử Cu2+ .
B. sự khử Fe2+ và sự oxi hoá Cu.
C. sự oxi hoá Fe và sự khử Cu2+.
D. sự oxi hoá Fe và sự oxi hoá Cu.
Câu 17: Kim loại X được sử dụng trong nhiệt kế, áp kế và một số thiết bị khác. Ở điều kiện thường, X là chất lỏng. Kim loại X là
A. W. B. Cr.
C. Hg. D. Pb.
Câu 18: Hòa tan hỗn hợp gồm K2O, BaO, Al2O3 và Fe3O4 vào nước (dư), thu được dung dịch X và hỗn hợp rắn Y. Sục khí CO2 đến dư vào dung dịch X, sau khi các phản ứng xảy ra hoàn toàn thu được kết tủa là
A. K2CO3. B. Fe(OH)3.
C. Al(OH)3. D. BaCO3.
Câu 19: Phát biểu nào sau đây là sai?
A. Hợp kim Cu - Ni dùng chế tạo chân vịt tàu biển.
B. Thạch cao sống có công thức hóa học là CaSO4.H2O.
C. Cho kim loại Fe nguyên chất vào dung dịch H2SO4 loãng xảy ra ăn mòn điện hóa học.
D. Cr(VI) oxit tác dụng với nước tạo ra hỗn hợp axit.
Câu 20: Hòa tan hết 0,54g Al trong 70ml dung dịch HCl 1M thu được dung dịch X. Cho 75ml dung dịch NaOH 1M vào X, sau khi các phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là
A. 1,56. B. 1,17.
C. 0,39. D. 0,78.
Câu 21: Cho m gam bột X gồm Mg và Fe vào 150 ml dung dịch Cu(NO3)2 2M và AgNO3 1M thu được dung dịch Y và 42,12 gam rắn Z. Cho Y tác dụng với dung dịch NaOH dư, lọc kết tủa nung trong không khí đến khối lượng không đổi được 18 gam rắn. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 15,88 gam. B. 18,72gam.
C. 16,48 gam. D. 18,12 gam.
Câu 22: Nhiệt phân m gam hỗn hợp Y gồm FeCO3, Cu(NO3)2 (4a mol) và Fe(NO3)3 (13a mol) một thời gian thu được rắn A và 4,032 lít hỗn hợp khí X có khối lượng 7,9 gam. Cho A tan hoàn toàn trong dung dịch chứa 0,35 mol H2SO4 thu được 0,18 mol hỗn hợp khí Z gồm NO và CO2 có khối lượng 7,22 gam và dung dịch T chỉ chứa muối. T tác dụng với tối đa 1,48 mol NaOH, phản ứng chỉ tạo thành 2 kết tủa. Phần trăm khối lượng của Fe(NO3)3 trong Y gần nhất với
A. 36%. B. 63%.
C. 21%. D. 12%.
Câu 23: Cho y gam kim loại M vào dung dịch Fe2(SO4)3, sau phản ứng khối lượng phần dung dịch tăng thêm y gam. Kim loại M là
A. Cu. B. Ba.
C. Zn. D. Ag.
Câu 24: Cho vài giọt dung dịch CuSO4 vào ống nghiệm chứa 3 ml dầu ăn, nhỏ tiếp dung dịch NaOH vào và đun nóng nhẹ. Hiện tượng quan sát được là
A. Tạo kết tủa Cu(OH)2 và không tan trong dầu ăn.
B. Tạo kết tủa Cu(OH)2 và Cu(OH)2 tan tạo dung dịch có màu xanh thẫm.
C. Tạo kết tủa Cu(OH)2 sau đó kết tủa bị tan trong NaOH dư.
D. Tạo kết tủa Cu(OH)2, lắng xuống dầu ăn nổi lên trên.
Câu 25: Hòa tan hoàn toàn x mol Fe vào dung dịch chứa y mol FeCl3 và z mol HCl, thu được dung dịch chỉ chứa một chất tan duy nhất. Biểu thức liên hệ giữa x, y và z là
A. 2x = y + 2z. B. 2x = y + z.
C. x = y – 2z. D. y = 2x.
Câu 26: Dãy gồm toàn các chất tác dụng với dung dịch HCl và dung dịch NaOH là (với điều kiện phản ứng cho đầy đủ)
A. NaHCO3, CrO và Al2O3.
B. NaHCO3, CrO và Al2O3.
C. Cr2O3, Al(OH)3 và NaHCO3.
D. KHCO3, Al(OH)3 và Cr2(SO4)3.
Câu 27: Đốt cháy 6,56 gam hỗn hợp Mg và Fe trong khí O2, thu được 9,12 gam hỗn hợp X chỉ gồm các oxit. Hòa tan hoàn toàn X trong dung dịch HCl vừa đủ, thu được dung dịch Y. Cho dung dịch NaOH dư vào Y, thu được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi, thu được 9,6 gam chất rắn. Mặt khác cho Y tác dụng với dung dịch AgNO3 dư, thu được m gam kết tủa. Giá trị của m là
A. 43,2. B. 32,65.
C. 45,92. D. 52,4.
Câu 28: Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm m gam Al và 4,56 gam Cr2O3 (trong điều kiện không có O2), sau khi phản ứng kết thúc, thu được hỗn hợp X. Cho toàn bộ X vào một lượng dư dung dịch HCl (loãng, nóng), sau khi các phản ứng xảy ra hoàn toàn, thu được 2,016 lít H2 (đktc). Còn nếu cho toàn bộ X vào một lượng dư dung dịch NaOH (đặc, nóng), sau khi các phản ứng kết thúc thì số mol NaOH đã phản ứng là
A. 0,14 mol. B. 0,06 mol.
C. 0,16 mol. D. 0,08 mol.
Câu 29: Điện phân dung dịch chứa 53,9 gam hỗn hợp muối NaCl và Cu(NO3)2 với điện cực trơ, màng ngăn xốp, đến khi nước điện phân ở cả hai điện cực thì ngừng điện phân, tại thời điểm này thể tích khí sinh ở anot gấp 1,5 lần thế tích khí thoát ra ở catot ở cùng điều kiện nhiệt độ và áp suất. Nhận xét không đúng là
A. Nếu cường độ dòng điện là 5 ampe thì thời gian điện phân là 3 giờ 13 phút.
B. Nếu điện phân với thời gian là 3 giờ 19 phút 26 giây với I = 5 ampe rồi dừng lại thì khối lượng dung dịch giảm là 28,30 gam.
C. Khối lượng kim loại bám vào catot là 6,4 gam.
D. tỉ lệ mol hai muối NaCl : CuSO4 là 6 : 1.
Câu 30: Cho Cu dư tác dụng với dung dịch Fe(NO3)3 được dung dịch X. Cho AgNO3 dư tác dụng với X được dung dịch Y. Cho Fe dư tác dụng với dung dịch Y được hỗn hợp kim loại Z. Số phản ứng xảy ra là
A. 6. B. 7.
C. 5. D. 4.
Bộ 10 đề thi Hóa học lớp 12 học kì 2 năm 2022 tải nhiều nhất – Đề 4
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 12
Thời gian làm bài: 45 phút
(Đề thi số 4)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh:..................................................................... Lớp: .............................
Cho nguyên tử khối của các nguyên tố: F = 19; Cl = 35,5; Br = 80; I = 127; Ag = 108; Li = 7; Na = 23; K = 39; Be = 9; Mg = 12; Ca = 40; Ba = 137; Al = 27; Fe = 56; Cr = 52; Cu = 64; Zn = 65; Mg = 24; O = 16; S = 32.
Câu 1. Kim loại nào sau đây phản ứng mãnh liệt nhất với nước ở nhiệt độ thường?
A. Fe. B. Al.
C. Na. D. Mg.
Câu 2. Cấu hình electron của Fe có dạng:
A. [Ar] 3d5.
B. [Ar] 4s2 3d6.
C. [Ar] 3d6.
D. [Ar] 3d6 4s2.
Câu 3. Khi dẫn từ từ khí CO2 đến dư vào dung dịch Ca(OH)2 thấy có
A. bọt khí bay ra.
B. kết tủa trắng, sau đó kết tủa tan dần.
C. kết tủa trắng xuất hiện.
D. bọt khí và kết tủa trắng.
Câu 4. Cho lượng dư các dung dịch: KOH, BaCl2, NH3, HCl, NaCl, Ba(OH)2 lần lượt tác dụng với dung dịch Al2(SO4)3. Số trường hợp thu được kết tủa sau phản ứng là
A. 1. B. 3.
C. 4. D. 2.
Câu 5. Trong quá trình điện phân dung dịch CuSO4, ở catot đã xảy ra sự
A. oxi hóa ion Cu2+.
B. khử nước.
C. oxi hóa nước.
D. khử ion Cu2+.
Câu 6. Chọn phát biểu đúng?
A. Sắt bền trong không khí vì có lớp màng Fe2O3 bền vững bảo vệ.
B. Sắt là kim loại có tính khử mạnh.
C. Trong tự nhiên, sắt tồn tại chủ yếu dạng hợp chất.
D. Sắt là kim loại có tính dẫn điện tốt hơn đồng.
Câu 7. Để nhận biết các chất riêng biệt sau: Na, Al, Al2O3 có thể dùng
A. H2O.
B. dung dịch HNO3.
C. dung dịch NaOH.
D. dung dịch HCl.
Câu 8. Dẫn CO dư qua hỗn hợp gồm Al2O3, Fe2O3, CuO, MgO đun nóng. Sau khi phản ứng hoàn toàn thu được hỗn hợp rắn gồm
A. Al, Fe, Cu, Mg.
B. Al, Fe, Cu, MgO.
C. Al2O3, Fe, Cu, Mg.
D. Al2O3, Fe, Cu, MgO.
Câu 9. Để thu được kim loại Cu từ dung dịch CuSO4 theo phương pháp thủy luyện, có thể dùng kim loại nào sau đây?
A. Ag. B. Ca.
C. Na. D. Fe.
Câu 10. Một loại nước cứng khi được đun sôi thì mất tính cứng. Trong loại nước cứng này có hòa tan những hợp chất nào sau đây?
A. Mg(HCO3)2, CaCl2.
B. Ca(HCO3)2, Mg(HCO3)2.
C. Ca(HCO3)2, MgCl2.
D. MgCl2, CaSO4.
Câu 11. Trong số các ion sau: Al3+, Mg2+, Fe2+, Fe3+. Ion có tính oxi hóa mạnh nhất là
A. Fe3+. B. Al3+.
C. Fe2+. D. Mg2+.
Câu 12. Dãy gồm các ion đều oxi hóa được kim loại Fe là
A. Zn2+, Cu2+, Ag+.
B. Cu2+, Al3+, Fe3+.
C. Mg2+, Cu2+, Ag+.
D. Fe3+, Cu2+, Ag+.
Câu 13. Ứng dụng nào sau đây của nhôm là sai?
A. Làm bình đựng nước vôi.
B. Làm dây cáp dẫn điện và dụng cụ nhà bếp.
C. Chế tạo hợp kim nhẹ, bền.
D. Dùng làm khung cửa và trang trí nội thất.
Câu 14. Cho hỗn hợp X gồm Mg và Fe vào dung dịch axit H2SO4 đặc, nóng đến khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y và một phần Fe không tan. Chất tan có trong dung dịch Y là
A. MgSO4.
B. MgSO4 và FeSO4.
C. MgSO4 và Fe2(SO4)3.
D. MgSO4, Fe2(SO4)3 và FeSO4.
Câu 15. Dãy chất gồm các chất đều tác dụng được với dung dịch H2SO4 (loãng) và NaOH?
A. Al2O3, Al(OH)3, CaCO3.
B. Al, Al2O3, Na2CO3.
C. Al2O3, Al, NaHCO3.
D. NaHCO3, Al2O3, Fe2O3.
Câu 16. Phân hủy Fe(OH)2 và Fe(OH)3 ở nhiệt độ cao ngoài không khí đến khối lượng không đổi, thu được chất rắn là
A. Fe2O3. B. Fe3O4.
C. FeO. D. Fe2O3 và FeO.
Câu 17. Kim loại tan trong dung dịch NaOH là
A. Cu. B. Mg.
C. Fe. D. Al.
Câu 18. Trong tự nhiên, chất X tồn tại dưới dạng ngậm nước X.2H2O gọi là thạch cao sống. Công thức của X là
A. MgCO3. B. CaSO4.
C. CaCO3. D. MgSO4.
Câu 19. Cho dãy các kim loại: Fe, K, Cs, Ca, Al, Na. Số kim loại kiềm trong dãy là
A. 3. B. 4.
C. 1. D. 2.
Câu 20. Phát biểu nào sau đây không đúng?
A. Nhôm bị phá hủy trong môi trường kiềm
B. Nhôm phản ứng được với H2SO4 đặc, nguội.
C. Nhôm là kim loại nhẹ, dẫn điện, dẫn nhiệt tốt.
D. Nhôm có tính khử mạnh chỉ sau kim loại kiềm và kiềm thổ trong cùng chu kì.
Câu 21. Cho các dung dịch: HNO3 loãng, NaOH, CuSO4, FeCl3, HCl. Kim loại Fe phản ứng với mấy chất?
A. 1. B. 2.
C. 3. D. 4.
Câu 22. Nồng độ phần trăm của dung dịch thu được khi cho 3,9 gam kali tác dụng với 108,2 gam H2O là
A. 4,00%. B. 4,99%.
C. 6,00%. D. 5,00%.
Câu 23. Cho 4,05 gam bột nhôm vào 100 ml dung dịch Fe(NO3)3 3M. Sau khi phản ứng xảy ra hoàn toàn, thu được m gam kim loại. Giá trị của m là
A. 16,8. B. 4,2.
C. 8,4. D. 11,2.
Câu 24. Sục khí CO2 đến dư vào 100 ml dung dịch KOH 1M, thu được m gam muối. Giá trị của m là
A. 8,4. B. 6,9.
C. 10. D. 5,3.
Câu 25. Điện phân 500 ml dung dịch AgNO3 xM với điện cực trơ, cường độ dòng điện là 9,65A đến khi catot bắt đầu có bọt khí thấy thoát ra thì thấy hết 50 phút. Giá trị của x là
A. 0,45. B. 0,30.
C. 0,15. D. 0,60.
Câu 26. Hòa tan hết 7,74 gam hỗn hợp bột Mg, Al cần vừa đủ 500 ml dung dịch X gồm HCl 1M và H2SO4 0,28M thu được dung dịch Y. Khối lượng muối khan thu được dung dịch Y. Khối lượng muối khan thu được khi cô cạn dung dịch Y là
A. 38,93 gam. B. 25,95 gam.
C. 77,86 gam. D. 103,85 gam.
Câu 27. Để điều chế được 1,35 tấn Al thì cần dùng m tấn quặng boxit chứa 75% Al2O3. Biết hiệu suất quá trình sản xuất là 92%. Giá trị của m là
A. 4,098. B. 3,966.
C. 3,696. D. 4,080.
Câu 28. Hòa tan hoàn toàn 7,5 gam hỗn hợp gồm Mg và Al bằng lượng vừa đủ V lít dung dịch HNO3 1M. Sau khi các phản ứng kết thúc, thu được 0,672 lít N2 (đktc) duy nhất và dung dịch chứa 54,9 gam muối. Giá trị của V là
A. 0,65. B. 0,72.
C. 0,70. D. 0,86.
Câu 29. Hòa tan 10 gam hỗn hợp bột Fe và Fe2O3 bằng một lượng dung dịch HCl vừa đủ thu được 1,12 lít khí (đktc) và dung dịch X. Cho NaOH dư vào dung dịch X thu được kết tủa, nung kết tủa trong không khí đến khối lượng không đổi được m gam chất rắn thì giá trị của m là
A. 12,0. B. 7,2.
C. 11,2. D. 16,0.
Câu 30. Hòa tan m gam Al trong dung dịch NaOH dư, sau phản ứng thu được 3,36 lít khí H2 (đktc). Giá trị của m là
A. 2,7. B. 1,35.
C. 5,4. D. 4,05.
Bộ 10 đề thi Hóa học lớp 12 học kì 2 năm 2022 tải nhiều nhất – Đề 5
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 12
Thời gian làm bài: 45 phút
(Đề thi số 5)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh:..................................................................... Lớp: .............................
Cho nguyên tử khối của các nguyên tố: F = 19; Cl = 35,5; Br = 80; I = 127; Ag = 108; Li = 7; Na = 23; K = 39; Be = 9; Mg = 12; Ca = 40; Ba = 137; Al = 27; Fe = 56; Cr = 52; Cu = 64; Zn = 65; Mg = 24; O = 16; S = 32.
Câu 1. Kim loại Fe không phản ứng với dung dịch nào sau đây?
A. NaNO3. В. НСl.
C. AgNO3. D. CuSO4.
Câu 2. Al(OH)3 tan được trong dung dịch
A. KOH. B. K2SO4.
C. NaNO3. D. NaCl.
Câu 3. Trong hợp chất, kim loại kiềm có số oxi hoá là
A. +2. B. +1.
C. -2. D. -1.
Câu 4. Số electron lớp ngoài cùng của các nguyên tử kim loại thuộc nhóm IIA là
A. 2. B. 1.
C. 3. D. 4.
Câu 5. Cho dung dịch FeCl2 tác dụng với dung dịch NaOH tạo thành kết tủa có màu
A. trắng.
B. nâu đỏ.
C. xanh thẫm.
D. trắng xanh.
Câu 6. Trong công nghiệp, quặng boxit dùng để sản xuất kim loại nhôm. Thành phần chính của quặng boxit là
A. Al(OH)3.H2O.
B. Al2(SO4)3.H2O.
C. Al(OH)3.2H2O.
D. Al2O3.2H2O.
Câu 7. Kim loại nào sau đây tác dụng được với dung dịch HCl?
A. Ag. B. Au.
C. Fe. D. Cu.
Câu 8. Dung dịch NaOH tạo kết tủa với dung dịch
A. H2SO4. B. BaCl2.
C. KCl. D. MgCl2.
Câu 9. FeO đóng vai trò chất khử trong phản ứng với dung dịch loãng chất nào sau đây?
A. NaOH. B. HNO3.
C. H2SO4. D. HCl.
Câu 10. Hoá chất nào sau đây có thể dùng để làm mất tính cứng tạm thời của nước?
A. NaCl. B. Ca(OH)2.
C. KNO3. D. MgCl2.
Câu 11. Trong các cation sau: Al3+, Mg2+, Fe2+, Fe3+. Cation có tính oxi hóa mạnh nhất là
A. Mg2+. B. Al3+.
C. Fe3+. D. Fe2+.
Câu 12. Al2O3 phản ứng được với cả hai dung dịch
A. KCl, KNO3.
B. Na2SO4, NaOH.
C. NaCl, H2SO4.
D. NaOH, H2SO4.
Câu 13. Kim loại X có màu trắng bạc, nóng chảy ở 660°C, có thể dát mỏng dùng làm giấy gói kẹo, thực phẩm,... Kim loại X là
A. Na. B. Al.
C. Fe. D. Mg.
Câu 14. Cho phương trình hoá học: xMg + yH2SO4 (đặc) → xMgSO4 + zS + yH2O (x, y, z là các hệ số cân bằng tối giản). Giá trị (x + y) bằng
A. 5. B. 7.
C. 8. D. 6.
Câu 15. Phèn chua có công thức: M2SO4.Al2(SO4)3.24H2O trong đó M+ là
A. NH4+. B. Na+.
C. Li+. D. K+.
Câu 16. Nhiệt phân đá vôi thu được vôi sống. Vôi sống được cho vào nước thu được vôi tôi. Vôi tôi được sử dụng rộng rãi trong nhiều ngành công nghiệp như sản xuất amoniac, clorua vôi, vật liệu xây dựng,.... Công thức của vôi tôi là
A. CaCO3. B. CaSO4.
C. Ca(OH)2. D. CaO.
X có thể là oxit nào sau đây?
A. K2O. B. Fe2O3.
C. Al2O3. D. MgO.
Câu 18. Kim loại kiềm nào dưới đây được sử dụng làm tế bào quang điện?
A. Li. B. Cs.
C. K. D. Na.
Câu 19. Điện phân NaCl nóng chảy (anot bằng than chì, catot bằng thép), ở catot thu được
A. Na. B. Cl2.
C. H2. D. NaOH.
Câu 20. Chất nào sau đây khi tác dụng với dung dịch HCl, thu được hai muối?
A. Fe3O4. B. Be(OH)2.
C. FeO. D. Fe2O3.
Câu 21. Cho dãy các kim loại: Fe, K, Cs, Ca, Al, Na. Số kim loại kiềm trong dãy là
A. 2. B. 4.
C. 2. D. 1.
Câu 22. Trong sản xuất nhôm, X được trộn với Al2O3 nhằm hạ nhiệt độ nóng chảy của hỗn hợp xuống 900°C, tạo được chất lỏng có tính dẫn điện tốt hơn Al2O3 nóng chảy. X là
A. natri hiđroxit. B. đolomit.
C. criolit. D. boxit.
Câu 23. Trong tự nhiên, canxi sunfat tồn tại dưới dạng CaSO4.2H2O được gọi là
A. đá vôi.
B. thạch cao sống.
C. thạch cao khan.
D. thạch cao nung.
Câu 24. Cho các kim loại: Na, K, Mg, Ba. Ở nhiệt độ thường, kim loại khử được nước chậm nhất là
A. K. B. Na.
C. Mg. D. Ba.
Câu 25. Dung dịch FeCl3 tác dụng được với
A. Ag. B. Pt.
C. Au. D. Cu.
Câu 26. NaHCO3 tác dụng với chất nào sau đây sinh ra kết tủa?
A. HCl. B. Ba(OH)2.
С. KОН. D. H2SO4.
Câu 27. Cation M+ có cấu hình electron ở lớp ngoài cùng là 2s22p6. M là
A. Na. B. Mg.
C. F. D. Ne.
Câu 28. Để thu được kim loại Cu từ dung dịch CuSO4, theo phương pháp thuỷ luyện, có thể dùng kim loại nào sau đây?
A. Fe. B. Ag.
C. Na. D. Ca.
Câu 29. Cho từ từ tới dư dung dịch chất X vào dung dịch AlCl3 thu được kết tủa keo trắng. Biết phản ứng xảy ra hoàn toàn. Chất X là
A. NaOH. B. KOH.
C. NH3. D. HCl.
Câu 30. Cho sơ đồ phản ứng sau:
Biết X1, X2, X3, X4, X5 là các hợp chất khác nhau của nguyên tố nhôm. Các chất X1 và X5 lần lượt là
A. Al2O3 và AlCl3.
B. Al2O3 và Al2(SO4)3.
C. AlCl3 và Al2O3.
D. Al2(SO4)3 và Al2O3.
Câu 31. Cho các phát biểu:
(a) Fe tác dụng với dung dịch AgNO3 dư thu được muối sắt (III).
(b) Nhôm, sắt bị thụ động hoá trong dung dịch HNO3 đặc, nguội.
(c) Be không tác dụng với nước ở nhiệt độ thường.
(d) Nhôm có khối lượng riêng lớn hơn sắt.
Số phát biểu đúng là
A. 1. B. 2.
C. 4. D. 3.
Câu 32. Chọn phát biểu đúng
A. Nhiệt phân natri clorua thu được kim loại natri và khí clo.
B. Trong các kim loại, kim loại kiềm có độ cứng lớn nhất.
C. Kim loại kiềm không tác dụng với dung dịch HNO3 đặc.
D. Cs phản ứng với nước mãnh liệt hơn Li trong cùng điều kiện.
Câu 33. Cho các dung dịch sau: Ba(HCO3)2, NaOH, AlCl3, KHSO4 được đánh ngẫu nhiên là X, Y, Z, T. Kết quả thí nghiệm của các chất X, Y, Z, T với các thuốc thử được ghi ở bảng sau:
|
Hoá chất |
X |
Y |
Z |
T |
|
Dung dịch HCl |
Khí bay ra |
Không hiện tượng |
Không hiện tượng |
Không hiện tượng |
|
Dung dịch Ba(OH)2 |
Kết tủa trắng không tan trong Ba(OH)2 dư |
Kết tủa trắng không tan trong Ba(OH)2 dư |
Không hiện tượng |
Kết tủa trắng tan trong Ba(OH)2 dư |
Chất Y là
A. AlCl3. B. NaOH.
C. Ba(HCO3)2. D. KHSO4.
Câu 34. Thực hiện các thí nghiệm sau:
(a) Đốt dây sắt trong khí clo dư.
(b) Cho FeO vào dung dịch HNO3 (loãng, dư).
(c) Cho Fe vào dung dịch Fe(NO3)3.
(d) Cho Fe vào dung dịch H2SO4 (loãng, dư).
Số thí nghiệm tạo thành muối sắt (II) là
A. 1. B. 3.
C. 2. D. 4.
Câu 35. Đốt cháy hoàn toàn 1,08 gam Al bằng lượng dư khí O2, thu được m gam chất rắn. Giá trị của m là
A. 2,04. B. 8,16.
C. 4,08. D. 1,72.
Câu 36. Để hòa tan hoàn toàn 5,4 gam Al cần dùng vừa đủ V (ml) dung dịch NaOH 0,5M. Giá trị của V là
A. 400. B. 300.
C. 100. D. 200.
Câu 37. Hòa tan hoàn toàn m gam bột nhôm vào dung dịch HNO3 dư, thu được 1,0752 lít hỗn hợp khí X (gồm NO và N2O, có tỷ lệ mol lần lượt là 3:1, đktc) và dung dịch chỉ chứa một muối. Giá trị của m là
A. 1,836. B. 1,404.
C. 1,620. D. 2,916.
Câu 38. Cho 3,76 gam hỗn hợp gồm MgO, CuO và Fe2O3, tác dụng vừa đủ với 0,06 lít dung dịch HCl 2,0M, rồi cô cạn dung dịch sau phản ứng thì số gam muối khan thu được là
A. 6,10. B. 4,93.
C. 7,06. D. 8,02.
Câu 39. Cho 17,82 gam hỗn hợp gồm Na, Na2O, Ba, BaO (trong đó oxi chiếm 12,57% về khối lượng) vào nước dư, thu được x mol khí H2 và dung dịch Y. Cho dung dịch CuSO4 dư vào Y, thu được 35,54 gam kết tủa. Giá trị của x là
A. 0,12. B. 0,10.
C. 0,08. D. 0,06.
Câu 40. Hỗn hợp X gồm Fe2O3, FeO và Cu (trong đó oxi chiếm 16,0% về khối lượng). Cho m gam X tác dụng với 500 ml dung dịch HCl 2,0M (dư), thu được dung dịch Y và còn lại 0,27m gam chất rắn không tan. Cho dung dịch AgNO3 dư vào Y, thu được khí NO (sản phẩm khử duy nhất của N+5) và 165,1 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 28. B. 48.
C. 32. D. 40.
Bộ 10 đề thi Hóa học lớp 12 học kì 2 năm 2022 tải nhiều nhất – Đề 6
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 12
Thời gian làm bài: 45 phút
(Đề thi số 6)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh:..................................................................... Lớp: .............................
Cho nguyên tử khối của các nguyên tố: F = 19; Cl = 35,5; Br = 80; I = 127; Ag = 108; Li = 7; Na = 23; K = 39; Be = 9; Mg = 12; Ca = 40; Ba = 137; Al = 27; Fe = 56; Cr = 52; Cu = 64; Zn = 65; Mg = 24; O = 16; S = 32.
Câu 1: Kim loại nào sau đây là kim loại kiềm?
A. Ca. B. Li.
C. Zn. D. Ba.
Câu 2: Tro thực vật được sử dụng như một loại phân bón cung cấp nguyên tố kali cho cây trồng do chứa muối kali cacbonat. Công thức của kali cacbonat là
A. KCl. B. KOH.
C. NaCl. D. K2CO3.
Câu 3: Kim loại có khối lượng riêng nhỏ nhất là
A. Hg. B. Cs.
C. Al. D. Li.
Câu 4: Kim loại M phản ứng được với: dung dịch H2SO4 (loãng), dung dịch FeCl3, dung dịch HNO3 (đặc, nguội). Kim loại M là
A. Al. B. Ag.
C. Zn. D. Fe.
Câu 5: Phát biểu nào sau đây là sai?
A. Các kim loại kiềm có nhiệt độ nóng chảy tăng dần từ Li đến Cs.
B. Các kim loại kiềm đều là kim loại nhẹ và nhẹ nhất là Li.
C. Các kim loại kiềm có bán kính nguyên tử lớn hơn so với các kim loại cùng chu kì.
D. Các kim loại kiềm có màu trắng bạc và có ánh kim.
Câu 6: Kim loại nào sau đây không tan được trong dung dịch HCl?
A. Al. B. Ag.
C. Zn. D. Mg.
Câu 7: Kim loại Fe đều phản ứng được với các dung dịch nào sau đây ?
A. NaCl, AlCl3.
B. MgSO4, CuSO4.
C. AgNO3, NaCl.
D. CuSO4, AgNO3.
Câu 8: Cho phản ứng hóa học: Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng trên xảy ra:
A. sự khử Fe2+ và sự oxi hóa Cu.
B. sự khử Fe2+ và sự khử Cu2+.
C. sự oxi hóa Fe và sự oxi hóa Cu.
D. sự oxi hóa Fe và sự khử Cu2+.
Câu 9: Hơi thủy ngân rất độc, bởi vậy khi làm vỡ nhiệt kế thủy ngân thì chất độc được dùng để rắc lên thủy ngân rồi gom lại là
A. vôi sống.
B. cát.
C. muối ăn.
D. lưu huỳnh.
Câu 10: Phương trình hóa học nào sau đây là sai?
A. 2Na + 2H2O → 2NaOH + H2.
B. 8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 15H2O.
C. 3Mg + 2Fe(NO3)3 → 3Mg(NO3)2 + 2Fe.
D. Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O.
Câu 11: Tiến hành các thí nghiệm sau:
(a) Cho lá Fe vào dung dịch gồm CuSO4 và H2SO4 loãng;
(b) Đốt dây Fe trong bình đựng khí O2;
(c) Cho lá Cu vào dung dịch gồm Fe(NO3)3 và HNO3;
(d) Cho lá Zn vào dung dịch HCl;
Số thí nghiệm có xảy ra ăn mòn điện hóa là:
A. 3. B. 2.
C. 1. D. 4.
Câu 12: Cho luồng khí H2 (dư) qua hỗn hợp các oxit CuO, Fe2O3, Ag2O, MgO nung ở nhiệt độ cao. Sau phản ứng hỗn hợp rắn còn lại là
A. Cu, Fe, Ag, MgO.
B. Cu, Fe, Ag2O, MgO.
C. Cu, Fe, Ag, Mg.
D. Cu, FeO, Ag2O, MgO.
Câu 13: Điện phân dung dịch gồm NaCl và HCl (điện cực trơ, màng ngăn xốp). Trong quá trình điện phân, so với dung dịch ban đầu thì giá trị pH của dung dịch thu được
A. không thay đổi.
B. tăng lên.
C. giảm xuống.
D. tăng lên sau đó giảm xuống.
Câu 14: Khi phân hủy CaCO3 ở nhiệt độ khoảng 1000°C thì thu được sản phẩm gồm CO2 và chất nào sau đây?
A. Ca(HCO3)2. B. Ca.
C. CO. D. CaO.
Câu 15: Hai chất được dùng để làm mềm nước cứng vĩnh cửu là
A. Na2CO3 và HCl.
B. Na2CO3 và Na3PO4.
C. Na2CO3 và Ca(OH)2.
D. NaCl và Ca(OH)2.
Câu 16: Dung dịch Na2CO3 tác dụng được với dung dịch:
A. NaCl. B. KCl.
C. CaCl2. D. NaNO3.
Câu 17: Hiđroxit nào sau đây dễ tan trong nước ở điều kiện thường?
A. A1(OH)3. B. Mg(OH)2.
C. Ba(OH)2. D. Cu(OH)2.
Câu 18: Kim loại nào sau đây vừa phản ứng được với dung dịch HCl, vừa phản ứng được với dung dịch NaOH?
A. Fe. B. Al.
C. Cu. D. Ag.
Câu 19: Dung dịch nào sau đây tác dụng được với Al(OH)3?
A. KOH. B. KCl.
C. NaNO3. D. Na2SO4.
Câu 20: Phèn chua được dùng trong ngành công nghiệp thuộc da, công nghiệp giấy, chất cầm màu trong ngành nhuộm vải, chất làm trong nước. Công thức hoá học của phèn chua là:
A. Li2SO4.Al2(SO4)3.24H2O.
B. Na2SO4.Al2(SO4)3.24H2O.
C. K2SO4.Al2(SO4)3.24H2O.
D. (NH4)2SO4.Al2(SO4)3.24H2O.
Câu 21: Dung dịch nào sau đây được dùng để xử lý lớp cặn CaCO3 bám vào ấm đun nước?
A. Muối ăn.
B. Cồn.
C. Nước vôi trong.
D. Giấm ăn.
Câu 22: Tiến hành các thí nghiệm sau:
(a) Điện phân Al2O3 nóng chảy (anot bằng than chì).
(b) Điện phân dung dịch CuSO4 (điện cực trơ).
(c) Cho mẩu K vào dung dịch AlCl3.
(d) Cho Fe vào dung dịch CuSO4.
(e) Cho Ag vào dung dịch HCl.
(g) Đun sôi nước cứng tạm thời.
Số thí nghiệm thu được hợp chất khí là:
A. 1. B. 2.
C. 3. D. 4.
Câu 23: Trong công nghiệp, natri hiđroxit được sản xuất bằng phương pháp:
A. điện phân dung dịch NaCl, không có màng ngăn điện cực.
B. điện phân dung dịch NaNO3, không có màng ngăn điện cực.
C. điện phân dung dịch NaCl, có màng ngăn điện cực.
D. điện phân NaCl nóng chảy.
Câu 24: Khi nhiệt phân hoàn toàn từng muối X, Y thì đều tạo ra số mol khí nhỏ hơn số mol muối tương ứng. Đốt một lượng nhỏ tinh thể Y trên đèn khí không màu, thấy ngọn lửa có màu vàng. Hai muối X, Y lần lượt là
A. KMnO4, NaNO3.
B. Cu(NO3) 2, NaNO3.
C. CaCO3, NaNO3.
D. NaNO3, KNO3.
Câu 25: Cho lượng dư Fe lần lượt tác dụng với các dung dịch: CuSO4, HCl, AgNO3, H2SO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn, số trường hợp sinh ra muối sắt (II) là
A. 1. B. 2.
C. 3. D. 4.
Câu 26: Cho hỗn hợp Fe, Cu phản ứng với dung dịch HNO3 loãng. Sau khi phản ứng hoàn toàn, thu được dung dịch chỉ chứa một chất tan và kim loại dư. Chất tan đó là
A. Cu(NO3)2. B. HNO3.
C. Fe(NO3)2. D. Fe(NO3)3.
Câu 27: Hòa tan Fe3O4 bằng lượng vừa đủ dung dịch HCl, thu được dung dịch X. Có bao nhiêu chất khi cho vào dung dịch X thì xảy ra phản ứng hóa học trong các chất: Ca(OH)2, Cu, AgNO3, Na2SO4?
A. 2. B. 1.
C. 3. D. 4.
Câu 28: Chất rắn X màu đỏ thẫm tan trong nước thành dung dịch màu vàng. Một số chất như S, P, C, C2H5OH… bốc cháy khi tiếp xúc với X. Chất X là
A. P. B. Fe2O3.
C. CrO3. D. Cu.
Câu 29: Khi cho lượng dư dung dịch KOH vào ống nghiệm đựng dung dịch kali đicromat, dung dịch trong ống nghiệm:
A. chuyển từ màu da cam sang màu vàng.
B. chuyển từ màu vàng sang màu đỏ.
C. chuyển từ màu da cam sang màu xanh lục.
D. chuyển từ màu vàng sang màu da cam.
Câu 30: Nước thải công nghiệp thường chứa các ion kim loại nặng như Hg2+, Pb2+, Fe3+,... Để xử lí sơ bộ nước thải trên, làm giảm nồng độ các ion kim loại nặng với chi phí thấp, người ta sử dụng chất nào?
A. NaCl. B. Ca(OH)2.
C. HCl. D. KOH.
Câu 31: Thực hiện các thí nghiệm sau:
(a) Sục khí Cl2 vào dung dịch NaOH ở nhiệt độ thường
(b) Cho Fe3O4 vào dung dịch HCl loãng (dư).
(c) Cho Fe3O4 vào dung dịch H2SO4 đặc, nóng (dư).
(d) Hòa tan hết hỗn hợp Cu và Fe2O3 (có số mol bằng nhau) vào dung dịch H2SO4 loãng (dư).
Trong các thí nghiệm trên, sau phản ứng, số thí nghiệm tạo ra hai muối là
A. 4. B. 3.
C. 2. D. 1.
Câu 32: Cho hỗn hợp X gồm Cu, Ag, Fe, Al tác dụng với oxi dư khi đun nóng được chất rắn Y. Cho Y vào dung dịch HCl dư, khuấy kĩ, sau đó lấy dung dịch thu được cho tác dụng với dung dịch NaOH loãng, dư. Lọc lấy kết tủa tạo thành đem nung trong không khí đến khối lượng không đổi thu được chất rắn Z. Biết các phản ứng xảy ra hoàn toàn. Thành phần của Z gồm:
A. Fe2O3, CuO.
B. Fe2O3, CuO, Ag.
C. Fe2O3, Al2O3.
D. Fe2O3, CuO, Ag2O.
Thí nghiệm đó là:
A. Cho dung dịch HCl vào bình đựng bột CaCO3.
B. Cho dung dịch H2SO4 đặc vào bình đựng lá kim loại Cu.
C. Cho dung dịch H2SO4 loãng vào bình đựng hạt kim loại Zn.
D. Cho dung dịch HCl đặc vào bình đựng tinh thể K2Cr2O7.
Câu 34: Cho các phản ứng xảy ra theo sơ đồ sau:
X1 + H2O X2 + X3 + H2
X2 + X4 BaCO3¯ + K2CO3 + H2O
Hai chất X2, X4 lần lượt là:
A. KOH, Ba(HCO3)2.
B. NaOH, Ba(HCO3)2.
C. KHCO3, Ba(OH)2.
D. NaHCO3, Ba(OH)2.
Câu 35: Cho 29,8 gam hỗn hợp bột gồm Zn và Fe vào 600 ml dung dịch CuSO4 0,5M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và 30,4 gam hỗn hợp kim loại. % về khối lượng của Fe trong hỗn hợp ban đầu là
A. 43,62%. B. 56,37%.
C. 64,42%. D. 37,58%.
Câu 36: Hấp thụ hoàn toàn 3,36 lít CO2 (đktc) vào dung dịch chứa a mol NaOH và b mol Na2CO3, thu được dung dịch X. Chia X thành hai phần bằng nhau. Cho từ từ phần một vào 120 ml dung dịch HCl 1M, thu được 2,016 lít CO2 (đktc). Cho phần hai phản ứng hết với dung dịch Ba(OH)2 dư, thu được 29,55 gam kết tủa. Tỉ lệ a : b tương ứng là
A. 2 : 5. B. 2 : 3.
C. 2 : 1. D. 1 : 2.
Câu 37: Điện phân nóng chảy hoàn toàn 5,96 gam MCln, thu được 0,04 mol Cl2. Kim loại M là
A. Ca. B. Na.
C. K. D. Mg.
Câu 38: Hòa tan hoàn toàn 21,6 gam Al bằng dung dịch HNO3 loãng, thu được 5,376 lít (đktc) hỗn hợp khí X gồm N2, N2O và dung dịch chứa m gam muối. Tỉ khối của X so với H2 bằng 18. Giá trị của m là
A. 153,56. B. 155,52.
C. 170,40. D. 172,80.
Câu 39: Cho 4,32 gam hỗn hợp X gồm Mg và Fe tác dụng với V lít (đktc) hỗn hợp khí Y gồm Cl2 và O2 (có tỉ khối so với H2 bằng 32,25), thu được hỗn hợp rắn Z. Cho Z vào dung dịch HCl, thu được 1,12 gam một kim loại không tan, dung dịch T và 0,224 lít khí H2 (đktc). Cho T vào dung dịch AgNO3 dư, thu được 27,28 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của V là
A. 1,536. B. 1,680.
C. 1,344. D. 2,016.
Câu 40: Hỗn hợp X gồm 3,92 gam Fe, 16 gam Fe2O3 và m gam Al. Nung X ở nhiệt độ cao trong điều kiện không có không khí, thu được hỗn hợp chất rắn Y. Chia Y thành hai phần bằng nhau. Phần một tác dụng với dung dịch H2SO4 loãng (dư), thu được 4a mol khí H2. Phần hai phản ứng với dung dịch NaOH dư, thu được a mol khí H2. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của m là
A. 5,40. B. 3,51.
C. 7,02. D. 4,05.
Bộ 10 đề thi Hóa học lớp 12 học kì 2 năm 2022 tải nhiều nhất – Đề 7
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 12
Thời gian làm bài: 45 phút
(Đề thi số 7)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh:..................................................................... Lớp: .............................
Cho nguyên tử khối của các nguyên tố: F = 19; Cl = 35,5; Br = 80; I = 127; Ag = 108; Li = 7; Na = 23; K = 39; Be = 9; Mg = 12; Ca = 40; Ba = 137; Al = 27; Fe = 56; Cr = 52; Cu = 64; Zn = 65; Mg = 24; O = 16; S = 32.
Câu 1: Chất nào sau đây không tác dụng với dung dịch AgNO3?
A. Fe(NO3)2. B. Cu.
C. FeCl3. D. HNO3.
Câu 2: Cho các kim loại Cu, Ag, Na, K và Ba, số kim loại điều chế được bằng phương pháp thủy luyện là
A. 2. B. 3.
C. 4. D. 6.
Câu 3: Kim loại có khả năng dẫn điện tốt nhất và kim loại có độ cứng cao nhất lần lượt là
A. Ag và W. B. Al và Cu.
C. Cu và Cr. D. Ag và Cr.
Câu 4: Từ hai muối X và Y thực hiện các phản ứng sau:
X X1 + CO2
X1 + H2O → X2
X2 + Y → X + Y1 + H2O
X2 + 2Y → X + Y2 + H2O
Hai muối X và Y tương ứng là
A. CaCO3 và NaHSO4.
B. BaCO3 và Na2CO3.
C. CaCO3 và NaHCO3.
D. MgCO3 và NaHCO3.
Câu 5: Kim loại Cu không tan trong dung dịch?
A. HNO3 đặc nóng.
B. H2SO4 đặc nóng.
C. HNO3 loãng.
D. H2SO4 loãng.
Câu 6: Trong thực tế, không sử dụng cách nào sau đây để bảo vệ kim loại sắt khỏi bị ăn mòn?
A. Gắn đồng với kim loại sắt.
B. Tráng kẽm lên bề mặt sắt.
C. Phủ một lớp sơn lên bề mặt sắt.
D. Tráng thiếc lên bề mặt sắt.
Câu 7: Phương trình hóa học nào sau đây sai?
A. 2Cr + 3H2SO4 (loãng) → Cr2(SO4)3 + 3H2.
B. 2Cr + 3Cl2 2CrCl3
C. Cr(OH)3 + 3HCl → CrCl3 + 3H2O
D. Cr2O3 + 2NaOH (đặc) 2NaCrO2 + H2O
Câu 8: Nếu cho dung dịch FeCl3 vào dung dịch NaOH thì xuất hiện kết tủa màu
A. vàng nhạt.
B. trắng xanh.
C. xanh lam.
D. nâu đỏ.
Câu 9: Nung hỗn hợp gồm Al, Fe3O4 và Cu ở nhiệt độ cao, thu được chất rắn X. Cho X vào dung dịch NaOH dư, thu được chất rắn Y và khí H2. Cho Y vào dung dịch chứa AgNO3, thu được chất rắn Z và dung dịch E chứa 3 muối. Biết các phản ứng xảy ra hoàn toàn. Cho các phát biểu sau:
(a). Cho dung dịch HCl vào E thấy có kết tủa trắng xuất hiện.
(b). Từ dung dịch E ta có thể điều chế được 3 kim loại.
(c). Cho dung dịch HCl vào E thấy có phản ứng hóa học xảy ra.
(d). Dung dịch E có thể tác dụng được với kim loại Cu.
(e). Chất rắn Z chỉ chứa Ag.
Tổng số phát biểu chắc chắn đúng là?
A. 3. B. 4.
B. 5. C. 2.
Câu 10: Hỗn hợp X gồm Fe, Fe3O4, Al, Mg. Cho m gam hỗn hợp X tác dụng với oxi sau một thời gian thu được m + 0,48 gam hỗn hợp rắn Y. Cho Y phản ứng với HNO3 loãng dư thu được 1,12 lít NO (sản phẩm khử duy nhất) và dung dịch Z. Cô cạn Z được m + 30,3 gam chất rắn khan. Số mol HNO3 phản ứng là
A. 0,58. B. 0,48.
C. 0,52. D. 0,64.
Câu 11: Quặng nào sau đây dùng để sản xuất gang?
A. Quặng apatit.
B. Quặng hematit.
C. Quặng đôlômit.
D. Quặng boxit.
Câu 12: Công dụng nào dưới đây không phải của Na2CO3?
A. sản xuất thuỷ tinh.
B. sản xuất xà phòng.
C. thêm vào bia để tạo gas.
D. sản xuất giấy.
Câu 13: Hỗn hợp X gồm BaO, FeO và Al2O3. Hòa tan X trong lượng nước dư, thu được dung dịch Y và phần không tan Z. Sục khí CO2 vào dung dịch Y tới dư thu được kết tủa trắng G. Dẫn khí CO dư đi qua Z nung nóng được chất rắn E, cho E tác dụng vơí NaOH dư, thấy tan một phần còn lại chất rắn F. Nhận xét nào sau đây đúng?
A. Kết tủa G chứa BaCO3, chất rắn E chứa Fe và Al2O3 dư.
B. Kết tủa G chứa Al(OH)3, chất rắn E chứa Fe và Al2O3 dư.
C. Kết tủa G chứa BaCO3, chất rắn E chứa Fe.
D. Kết tủa G chứa Al(OH)3, chất rắn E chứa Fe.
Câu 14: Cho 54,04 gam hỗn hợp gồm Cu, Fe3O4 vào dung dịch HCl thu được dung dịch X và còn 2,24 gam chất rắn không tan. Cho dung dịch AgNO3 dư vào dung dịch X thu được 0,98 lít khí Y không màu hoá nâu ngoài không khí (sản phẩm khử duy nhất, ở đktc) và m gam kết tủa. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị gần đúng của m là
A. 268,54. B. 226,01.
C. 282,71. D. 277,99.
Câu 15: Thực hiện các thí nghiệm sau:
(a) Cho Cr2O3 vào dung dịch NaOH loãng dư.
(b) Cho bột Al tiếp xúc với khí Cl2.
(c) Cho CrO3 vào lượng nước dư.
(d) Cho CaO vào nước dư.
(e) Cho Sn vào dung dịch FeCl3.
(f) Cho hỗn hợp gồm Al và Na2O vào nước dư.
Số thí nghiệm xảy ra ở điều kiện thường là
A. 6. B. 4.
C. 5. D. 3.
Câu 16: Dẫn từ từ V lít khí CO2 (đktc) vào một cốc chứa 200 ml dung dịch hai bazơ KOH 0,2M và Ba(OH)2 0,1M thu được m gam kết tủa trắng. Nếu V nằm trong khoảng 0,336 ≤ V ≤ 1,568 thì m sẽ nằm trong khoảng nào?
A. 1,97 ≤ m ≤ 3,94.
B. 1,97 ≤ m ≤ 2,955.
C. 2,955 ≤ m ≤ 3,94.
D. Kết quả khác.
Câu 17: Hỗn hợp khí X gồm O2 và Cl2 có tỷ khối so với hiđro bằng 25,75. Thể tích của hỗn hợp X (đktc) cần dùng để phản ứng với vừa đủ 9,6 gam Cu là
A. 5,6 lít.
B. 3,36 lít.
C. 2,24 lít.
D. 4,48 lít.
Câu 18: Dãy chất nào sau đây vừa tác dụng với dung dịch HCl, vừa tác dụng với dung dịch NaOH là
A. AlCl3 và Al(OH)3.
B. AlCl3 và Al2O3.
C. Al(OH)3 và Al2O3.
D. AlCl3 và Al2(SO4)3.
Câu 19: Cho m gam Mg vào dung dịch X gồm 0,03 mol Zn(NO3)2 và 0,05 mol Cu(NO3)2, sau một thời gian thu được 5,25 gam kim loại và dung dịch Y. Cho dung dịch NaOH vào Y, khối lượng kết tủa lớn nhất thu được là 6,67 gam. Giá trị của m là
A. 4,05. B. 2,86.
C. 2,02. D. 3,60.
Câu 20: Có bốn dung dịch chứa trong các lọ mất nhãn: AlCl3, NH4NO3, K2CO3 và NH4HCO3. Có thể dùng một thuốc thử duy nhất để phân biệt bốn dung dịch trên. Dung dịch thuốc thử đó là
A. HCl. B. quỳ tím.
C. AgNO3. D. Ba(OH)2.
Câu 21: Phát biểu nào sau đây là đúng?
A. Trong bảng tuần hoàn các nguyên tố hóa học, crom thuộc chu kì 4, nhóm VIB.
B. Các oxit của crom đều là oxit bazơ.
C. Trong các hợp chất, số oxi hóa cao nhất của crom là +6.
D. Trong các phản ứng hóa học, hợp chất crom(III) vừa đóng vai trò chất oxi hóa và chất khử.
Câu 22: Khi cho Ba(OH)2 dư vào dung dịch chứa FeCl3, CuSO4 và AlCl3 thu được kết tủa. Nung kết tủa trong không khí đến khi khối lượng không đổi, thu được chất rắn X. Trong chất rắn X gồm:
A. FeO, CuO và Al2O3 .
B. Fe2O3, CuO và BaSO4.
C. Fe3O4, CuO và BaSO4.
D. Fe2O3 và CuO.
Câu 23: Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm 0,03 mol Cr2O3; 0,04 mol FeO và a mol Al. Sau một thời gian phản ứng, trộn đều, thu được hỗn hợp chất rắn Y. Chia Y thành hai phần bằng nhau. Phần một phản ứng vừa đủ với 400 ml dung dịch NaOH 0,1M (loãng). Phần hai phản ứng với dung dịch HCl loãng, nóng (dư), thu được 1,12 lít khí H2 (đktc). Giả sử trong phản ứng nhiệt nhôm, Cr2O3 chỉ bị khử thành Cr. Phần trăm khối lượng Cr2O3 đã phản ứng là
A. 20,00%. B. 33,33%. C. 50,00%. D. 66,67%.
Câu 24: Điện phân dung dịch X chứa a mol CuSO4 và 0,15 mol KCl (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) trong thời gian t giây thu được 2,24 lít khí ở anot (đktc). Nếu thời gian điện phân là 2t giây thì tông thể tích khí thu được ở 2 điện cực là 4,76 lít (đktc). Biết hiệu suất của quá trình điện phân đạt 100% và các khí sinh ra không tan trong dung dịch. Giá trị của a là
A. 0,20. B. 0,15.
C. 0,25. D. 0,30.
Câu 25: Dẫn hỗn hợp khí gồm CO2, O2, N2 và H2 qua dung dịch NaOH. Khí bị hấp thụ là
A. N2. B. O2.
C. CO2. D. H2.
Câu 26: Hòa tan hết 18,38 gam hỗn hợp X gồm Ba, BaO, Na và Na2O vào nước thu được dung dịch Y và 0,896 lit khí H2 (đktc). Hấp thụ hoàn toàn 4,48 lit CO2 vào dung dịch Y, tạo thành dung dịch Z và m gam kết tủa. Đun nóng để cô cạn dung dịch Z thu được a gam rắn khan. Mặt khác, cho Y vào dung dịch Al2(SO4)3 dư tạo thành 31,62 gam kết tủa. Tổng giá trị (m + a) gần với giá trị nào nhất sau đây?
A. 27. B. 26.
C. 30. D. 28
Câu 27: Để trung hòa 20 ml dung dịch HCl 0,1M cần 10 ml dung dịch NaOH nồng độ xM. Giá trị của x là
A. 0,3. B. 0,4.
C. 0,2. D. 0,1.
Câu 28: Cho lá Al vào dung dịch HCl, có khí thoát ra. Thêm vài giọt dung dịch CuSO4 vào thì
A. phản ứng ngừng lại.
B. tốc độ thoát khí tăng.
C. tốc độ thoát khí giảm.
D. tốc độ thoát khí không đổi.
Câu 29: Cho m gam hỗn hợp X gồm Mg, Al, MgO, Al2O3 và tác dụng với dung dịch hỗn hợp Y chứa NaHSO4 và 0,23 mol HNO3 thu được dung dịch Z chỉ chứa (m + 218,01) gam hỗn hợp các muối trung hòa và V lít hỗn hợp khí T (đktc) có tỉ khối hơi đối với H2 là 8,85. Dung dịch Z tác dụng tối đa với 500 ml dung dịch NaOH 4,5M, đun nhẹ, lọc thu được 17,4 gam kết tủa và 1,12 lít khí (đktc). Biết số mol khí có khối lượng phân tử nhỏ nhất trong T là 0,11 mol, các phản ứng xảy ra hoàn toàn. Giá trị của V là
A. 3,36. B. 5,60.
C. 6,72. D. 4,48.
Câu 30. Dẫn luồng khí H2 đến dư qua ống sứ chứa hỗn hợp gồm Al2O3, CuO, MgO, Fe3O4 nung nóng, kết thúc phản ứng lấy phần rắn X trong ống sứ cho vào dung dịch HCl loãng dư, thu được dung dịch Y. Các muối có trong dung dịch Y là
A. AlCl3, MgCl2, FeCl3, CuCl2.
B. MgCl2, AlCl3, FeCl2.
C. MgCl2, AlCl3, FeCl2, CuCl2.
D. AlCl3, FeCl3, FeCl2, CuCl2.
Bộ 10 đề thi Hóa học lớp 12 học kì 2 năm 2022 tải nhiều nhất – Đề 8
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 12
Thời gian làm bài: 45 phút
(Đề thi số 8)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh:..................................................................... Lớp: .............................
Cho nguyên tử khối của các nguyên tố: F = 19; Cl = 35,5; Br = 80; I = 127; Ag = 108; Li = 7; Na = 23; K = 39; Be = 9; Mg = 12; Ca = 40; Ba = 137; Al = 27; Fe = 56; Cr = 52; Cu = 64; Zn = 65; Mg = 24; O = 16; S = 32.
Câu 1: Dung dịch nào sau đây không tác dụng với Cu?
A. HCl. B. Fe(NO3)3.
C. AgNO3. D. HCl có hòa tan O2.
Câu 2: Điện phân dung dịch X gồm 0,04 mol AgNO3 và 0,06 mol Fe(NO3)3 với I = 5,36A bằng điện cực trơ, sau t giây thấy catot tăng 5,44 gam. Giá trị của t là
A. 2520,5. B. 1440.
C. 1800. D. 1440,5.
Câu 3: Để loại CuSO4 lẫn trong dung dịch FeSO4, cần dùng thêm lượng dư chất nào sau đây?
A. Al. B. Fe.
C. Zn. D. Ni.
Câu 4: Tiến hành các thí nghiệm sau:
(1) Cho Zn vào dung dịch AgNO3.
(2) Cho Fe vào dung dịch Fe2(SO4)3.
(3) Cho Ba vào dung dịch CuSO4.
(4) Dẫn khí CO (dư) qua bột CuO nóng.
Các thí nghiệm có tạo thành kim loại là
A. (1) và (2). B. (1) và (4).
C. (3) và (4). D. (2) và (3).
Câu 5: Có năm dung dịch đựng riêng biệt trong năm ống nghiệm: (NH4)2SO4, FeCl2, Cr(NO3)3, K2CO3 và Al(NO3)3. Cho dung dịch Ba(OH)2 đến dư vào năm dung dịch trên. Sau khi phản ứng kết thúc, số ống nghiệm có kết tủa là
A. 3. B. 5.
C. 2. D. 4.
Câu 6: Cho dãy các chất: FeCl2, CuSO4, BaCl2, KNO3, Al(OH)3, Ca(HCO3)2., Cr(OH)3, CrO Số chất trong dãy phản ứng được với dung dịch NaOH là
A. 4. B. 5.
C. 3. D. 6.
Câu 7: Cation M2+ có cấu hình electron lớp ngoài cùng 2s22p6. M là kim loại nào sau đây?
A. Be. B. Mg.
C. Ca. D. Ba.
Câu 8: Có các hóa chất sau: HCl, CaO, K3PO4, Na2CO3, Na. Hóa chất nào sau đây làm mềm nước cứng tạm thời chứa Ca(HCO3)2?
A. CaO; K3PO4; Na2CO3.
B. Cả 5 chất.
C. Na2CO3, K3PO4.
Câu 9: Dãy nào sau đây gồm tất cả các chất tác dụng được với Al (dạng bột)?
A. Dung dịch FeCl3; H2SO4 đặc, nguội; dung dịch KOH.
B. Cl2; dung dịch Ba(OH)2; dung dịch HCl; O2.
C. H2; I2; dung dịch HNO3 đặc, nguội; dung dịch FeCl3.
D. dung dịch Na2SO4, dung dịch NaOH, Cl2.
Câu 10: Nung hỗn hợp gồm 10,8g bột nhôm với 16g bột Fe2O3 không có không khí, nếu hiệu suất phản ứng 80% thì khối lượng Al2O3 thu được là
A. 8,16g. B. 10,20g.
C. 20,40g. D. 16,32g.
Câu 11: Cho các chất sau: Cr, CrO, Cr(OH)2, Cr2O3, Cr(OH)3. Có bao nhiêu chất thể hiện tính chất lưỡng tính?
A. 3. B. 1.
C. 4. D. 2.
Câu 12: Thêm dung dịch NaOH dư vào dung dịch muối CrCl3, nếu thêm tiếp dung dịch brom thì thu được sản phẩm có chứa crom là
A. CrO2.
B. Cr(OH)3.
C. Na2Cr2O7.
D. Na2CrO4.
Câu 13: Cho ít bột Fe vào dung dịch AgNO3 dư, sau khi kết thúc thí nghiệm thu được dung dịch X gồm
A. AgNO3, Fe(NO3)2.
B. Fe(NO3)2.
C. Fe(NO3)3, AgNO3.
D. Fe(NO3)3.
Câu 14: Khi cho dung dịch muối sắt(II) vào dung dịch kiềm, thu được kết tủa, nung kết tủa trong không khí đến khối lượng không đổi thu được chất rắn là
A. Fe(OH)2. B. Fe2O3.
C. Fe(OH)3. D. FeO.
Câu 15: Nhúng thanh sắt lần lượt vào các dung dịch sau: CuCl2, AgNO3 dư, ZnCl2, FeCl3, HCl, HNO3 loãng. Số trường hợp xảy ra phản ứng tạo hợp chất sắt(II) là
A. 4. B. 3.
C. 5. D. 2.
Câu 16: Để tác dụng hoàn toàn với 4,64 gam hỗn hợp FeO, Fe2O3, Fe3O4 cần dùng vừa đủ 160 ml dung dịch HCl 1M. Nếu khử hoàn toàn 4,64 g hỗn hợp trên bằng CO ở nhiệt độ cao thì khối lượng Fe thu được là
A. 3,36g. B. 4,36g.
C. 3,63g. D. 4,63g.
Câu 17: Hoà tan hoàn toàn 12 gam hỗn hợp X gồm Fe, Cu bằng dung dịch HNO3 dư, kết thúc thí nghiệm thu được 6,72 lít (đktc) hỗn hợp B gồm NO và NO2 có khối lượng 12,2 gam. Khối lượng muối nitrat sinh ra là
A. 43 gam. B. 34 gam.
C. 3,4 gam. D. 4,3 gam.
Câu 18: Cho nguyên tử Cu (z = 29), cấu hình electron của ion Cu2+ là
A. 1s22s22p63s23p63d9.
B. 1s22s22p63s23p64s23d7.
C. 1s22s22p63s23p64s13d10.
D. 1s22s22p63s23p63d104s1.
Câu 19: Cho các dung dịch X1: dung dịch HCl; X2: dung dịch KNO3; X3: dung dịch HCl + KNO3; X4: dung dịch Fe2(SO4)3; X5: AgNO3. Dung dịch nào có thể hoà tan được bột Cu?
A. X1, X4, X2.
B. X3, X4, X5.
C. X3, X2.
D. X1, X2, X3, X4.
Câu 20: Trong các hiện tượng thực hành dưới đây, hiện tượng nào miêu tả không chính xác?
A. Nhúng lá sắt đã đánh sạch gỉ vào dung dịch CuSO4, lá sắt chuyển sang màu đỏ.
B. Thả mẩu kẽm vào hai ống nghiệm đều chứa dung dịch H2SO4. Thêm vào ống nghiệm thứ nhất vài giọt FeSO4 thấy khí thoát ra ở ống nghiệm này nhanh hơn.
C. Cho mẩu Na vào dung dịch đựng FeCl2 thấy có khí thoát ra đồng thời có kết tủa màu nâu đỏ.
D. Thêm dung dịch NH3 dư vào dung dịch AlCl3 thấy có kết tủa, sục khí CO2 dư vào ống nghiệm chứa kết tủa trên thấy kết tủa không tan.
Câu 21: Trong tự nhiên, canxi sunfat tồn tại dưới dạng muối ngậm nước (CaSO4.2H2O) được gọi là
A. boxit.
B. đá vôi.
C. thạch cao sống.
D. thạch cao nung.
Câu 22: Tiến hành nhiệt phân hoàn toàn m gam hỗn hợp X gồm Cu(NO3)2 và Cu trong một bình kín, thu được chất rắn Y có khối lượng (m – 7,36) gam. Cho toàn bộ chất rắn Y tác dụng với dung dịch H2SO4 đặc nóng dư đến khi phản ứng xảy ra hoàn toàn thu được 0,672 lít SO2 (đktc) là sản phẩm khử duy nhất. Giá trị của m là
A. 19,52. B. 20,16.
C. 22,08. D. 25,28.
Câu 23: Cho dung dịch chứa FeCl2 và CrCl3 tác dụng với dung dịch NaOH dư, lấy kết tủa thu được nung trong không khí đến khối lượng không đổi, chất rắn thu được là
A. FeO, Cr2O3.
B. chỉ có Fe2O3.
C. chỉ có Cr2O3.
D. Fe2O3, Cr2O3.
Câu 24: Cho 41,68 gam hỗn hợp F gồm Fe3O4 và kim lọai M vào dung dịch HNO3 50,4% đun nóng, khuấy đều hỗn hợp để phản ứng xảy ra hoàn toàn thu được 4,032 lít NO2 (đktc); dung dịch G và 17,28 gam kim loại M. Cho dung dịch NaOH dư vào dung dịch G thu được kết tủa K. Nung K trong không khí đến khối lượng không đổi thu được 24,72 gam chất rắn R. Biết M có hóa trị không đổi trong các phản ứng trên, khí NO2 là sản phẩm khử duy nhất của N+5. Khối lượng dung dich HNO3 50,4% tối thiểu để hòa tan hoàn toàn 41,68 gam hỗn hợp F là
A. 85,0. B. 95,0.
C. 112,5. D. 125,0.
Câu 25: Cho 1 gam kim loại R vào 200 ml dung dịch AgNO3 0,25M đến khi phản ứng xảy ra hoàn toàn thu được dung dịch không chứa ion Ag+ và có khối lượng giảm so với khối lượng dung dịch AgNO3 ban đầu là 4,4 gam. Kim loại R là ?
A. Cu. B. Zn.
C. Ca. D. Fe.
Câu 26: Đốt Fe trong khí clo thiếu thu được hỗn hợp X gồm 2 chất rắn. Hai chất trong X là
A. FeCl3 và Fe.
B. FeCl2 và Fe.
C. FeCl2 và FeCl3.
D. FeO và FeCl2.
Câu 27: Hỗn hợp X gồm Ba, Na và Al, trong đó nAl = 6nBa. Cho m gam X vào nước dư đến phản ứng xảy ra hoàn toàn thu được 1,792 lít khí H2 (đktc) và 0,54 gam chất rắn. Giá trị của m là
A. 5,27. B. 3,81.
C. 3,45. D. 3,90.
Câu 28: Cho 30,3 gam hỗn hợp Al và Zn (tỉ lệ mol 4:3) tan hết trong dung dịch chứa a mol HNO3 thì sau phản ứng thu được 4,48 lít hỗn hợp khí N2O và NO (đktc) có tỉ khối hơi với metan là 2,3125; dung dịch Z. Biết rằng dung dịch Z phản ứng tối đa với 4,3 mol NaOH. Giá trị a là
A. 3,5785. B. 3,5875.
C. 3,6785. D. 3,6875.
Câu 29: Cho các nhận định sau:
(1) Chỉ có kim loại kiềm mới có cấu trúc lớp electron ngoài cùng là ns1.
(2) Các kim loại Ca, Ba và Mg khử nước mạnh ở nhiệt độ thường tạo ra dung dịch bazơ.
(3) CuSO4 khan có thể dùng để phát hiện nước lẫn trong dầu hoả (dầu hôi) hoặc xăng.
(4) Trong tự nhiên crom chỉ có ở dạng hợp chất. Quặng chủ yếu của crom là cromit FeO.Cr2O3.
(5) Trong mọi hợp chất, các kim loại kiềm thổ chỉ có một mức oxi hóa duy nhất là +2.
Số nhận định đúng là
A. 1. B. 2.
C. 4. D. 3.
Câu 30: Cho 11,2 gam Fe vào 400ml dung dịch AgNO3 1,2M. Khối lượng kết tủa thu được sau phản ứng xảy ra hoàn toàn là
A. 54,08 gam. B. 43,2 gam.
C. 48,6 gam. D. 51,84 gam.
Bộ 10 đề thi Hóa học lớp 12 học kì 2 năm 2022 tải nhiều nhất – Đề 9
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 12
Thời gian làm bài: 45 phút
(Đề thi số 9)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh:..................................................................... Lớp: .............................
Cho nguyên tử khối của các nguyên tố: F = 19; Cl = 35,5; Br = 80; I = 127; Ag = 108; Li = 7; Na = 23; K = 39; Be = 9; Mg = 12; Ca = 40; Ba = 137; Al = 27; Fe = 56; Cr = 52; Cu = 64; Zn = 65; Mg = 24; O = 16; S = 32.
Câu 1: Dung dịch muối không phản ứng với Fe là
A. AgNO3. B. CuSO4.
C. MgCl2. D. FeCl3.
Câu 2: Sắt không tan được trong dung dịch nào sau đây?
A. H2SO4 loãng, nguội.
B. H2SO4 đặc, nguội.
C. HNO3 đặc, nóng.
D. HCl đặc, nguội.
Câu 3: Nguyên tử của nguyên tố nào sau đây có cấu hình electron bất thường?
A. Fe. B. Cr.
C. Al. D. Na.
Câu 4: Sản phẩm tạo thành có chất kết tủa khi dung dịch Fe2(SO4)3 tác dụng với dung dịch
A. NaOH. B. Na2SO4.
C. NaCl. D. CuSO4.
Câu 5: Cặp chất nào sau đây không xảy ra phản ứng?
A. Fe2+ và Cu2+.
B. Fe2+ và Ag+.
C. Zn và Fe2+.
D. Zn và Cr3+.
Câu 6: Hợp chất sắt (III) không thể hiện tính oxi hoá khi cho
A. Fe2O3 tác dụng với Al.
B. Fe tác dụng với dung dịch Fe2(SO4)3.
C. Zn tác dụng với dung dịch FeCl3.
D. dung dịch Fe(NO3)3 tác dụng với dung dịch NH3.
Câu 7: Hòa tan Fe trong HNO3 dư thấy sinh ra hỗn hợp khí chứa 0,03 mol NO2 và 0,02 mol NO. Khối lượng Fe bị hòa tan bằng
A. 0,56 gam. B. 1,12 gam.
C. 1,68 gam. D. 2,24 gam.
Câu 8: Ngâm hỗn hợp A gồm 3 kim loại Fe, Ag và Cu trong dung dịch chỉ chứa chất tan B thấy Fe, Cu phản ứng hoàn toàn nhưng lượng Ag không đổi. Chất B là
A. AgNO3.
B. Fe(NO3)3.
C. Cu(NO3)2.
D. HNO3.
Câu 9: Phân hủy Fe(OH)3 ở nhiệt độ cao đến khối lượng không đổi, thu được chất rắn là
A. FeO. B. Fe2O3.
C. Fe3O4. D. Fe(OH)2.
Câu 10: Kim loại X tác dụng với dung dịch H2SO4 loãng rồi lấy khí thu được để khử oxit kim loại Y. Kim loại X, Y lần lượt là
A. Cu, Fe.
B. Fe, Cu.
C. Cu, Ag.
D. Ag, Cu.
Câu 11: Cấu hình electron của 26Fe3+ là
A. 1s22s22p63s23p63d34s2.
B. 1s22s22p63s23p63d44s1.
C. 1s22s22p63s23p63d64s2.
D. 1s22s22p63s23p63d5.
Câu 12: Hòa tan Fe3O4 trong lượng dư dung dịch H2SO4 loãng được dung dịch X. Dung dịch X tác dụng được với bao nhiêu chất trong số các chất sau: Cu; NaOH; Br2; AgNO3; KMnO4; MgSO4; Mg(NO3)2; Al?
A. 5.
B. 6.
C. 7.
D. 8.
Câu 13: Cho dãy chuyển hoá sau : Fe FeCl3 FeCl2 Fe(NO3)3. X, Y, Z lần lượt là
A. Cl2, Ag, HNO3.
B. HCl, Cl2, AgNO3.
C. Cl2, Fe, HNO3.
D. Cl2, Fe, Cu(NO3)2.
Câu 14: Để khử hoàn toàn 30 gam hỗn hợp CuO, FeO, Fe2O3, Fe3O4, MgO cần dùng 5,6 lít khí CO (ở đktc). Khối lượng chất rắn sau phản ứng là
A. 26 gam.
B. 24 gam.
C. 28 gam.
D. 22 gam.
Câu 15: Cho cân bằng hóa học sau: Cr2O72- + H2O 2 CrO42- + 2H + .
Màu vàng cam của dung dịch K2Cr2O7 chuyển thành dung dịch màu vàng hoặc có kết tủa vàng tươi nếu
A. thêm dung dịch NaOH hoặc thêm dung dịch BaCl2.
B. thêm dung dịch H2SO4 loãng hoặc dung dịch NaCl.
C. thêm dung dịch H2SO4 loãng hoặc dung dịch BaCl2.
D. thêm dung dịch NaOH hoặc dung dịch HCl.
Câu 16: Nung hỗn hợp bột gồm 15,2 gam Cr2O3 và m gam Al ở nhiệt độ cao. Sau khi phản ứng hoàn toàn, thu được 23,3 gam hỗn hợp rắn X. Cho toàn bộ hỗn hợp X phản ứng với axit HCl (dư) thoát ra V lít khí H2 (ở đktc). Giá trị của V là
A. 7,84. B. 4,48.
C. 3,36. D. 10,08.
Câu 17: Dung dịch muối FeCl3 không tác dụng với kim loại nào dưới đây?
A. Zn. B. Fe.
C. Cu. D. Ag.
Câu 18: Cho hỗn hợp gồm a (mol) Mg và b (mol) Fe vào dung dịch chứa c (mol) AgNO3, khi các phản ứng xảy ra hoàn toàn thu được dung dịch X gồm 2 muối và chất rắn Y (gồm 2 kim loại).
A. 2a ≤ c ≤ 2(a + b).
B. 2a < c < 2(a + b).
C. c ≤ 2(a + b).
D. 2(a – b) < c < 2(a + b).
Câu 19: Nhiệt phân Fe(NO3)2 trong môi trường khí trơ. Sau khi các phản ứng xảy ra hoàn toàn, thu được sản phẩm gồm
A. FeO, NO2, O2.
B. Fe2O3, NO2, O2.
C. Fe3O4, NO2, O2.
D. Fe, NO2, O2.
Câu 20: Lần lượt cho một mẫu Ba và các dung dịch K2SO4, NaHCO3, HNO3 và NH4Cl. Số trường hợp xuất hiện kết tủa là
A. 3. B. 4.
C. 2. D. 1.
Câu 21: Hòa tan m gam hỗn hợp Mg, Fe (tỉ lệ khối lượng tương ứng là 6 : 7) bằng dung dịch HCl dư thu được dung dịch X chứa 3 chất tan có tỉ lệ mol là 2 : 1 : 1 và 672 ml khí H2 .Cho X tác dụng dư dung dịch AgNO3 được khí NO (sản phẩm khử duy nhất của N+5) và a gam kết tủa. Các phản ứng xảy ra hoàn toàn, các khí đo ở điều kiện chuẩn. Giá trị của a là
A. 10,045. B. 10,315.
C. 11,125. D. 8,61.
Câu 22: Hoà tan hết hỗn hợp bột gồm m gam Cu và 4,64 gam Fe3O4 vào dung dịch H2SO4 loãng, dư, sau phản ứng hoàn toàn thu được dung dịch X. Dung dịch X làm mất màu vừa đủ 100 ml dung dịch KMnO4 0,1M. Giá trị của m là
A. 1,24 gam. B. 0,64 gam.
C. 0,96 gam. D. 3,2 gam.
Câu 23: Cho Na vào dung dịch chứa 2 muối MgSO4 và CuSO4 thu được khí X, dung dịch Y và hỗn hợp kết tủa Z. Nung kết tủa Z được chất rắn R. Cho X đi qua R nung nóng đến phản ứng hoàn toàn thu được chất rắn P. Cho P vào dung dịch HCl dư. Nhận xét nào sau đây là đúng?
A. P hoàn toàn không tan trong HCl.
B. P tan hết trong HCl.
C. P tan một phần nhưng không tạo khí.
D. P tan một phần trong HCl tạo khí.
Câu 24: Ion Fe2+ thể hiện tính khử trong phản ứng sau đây?
A. 2Fe2+ + Cl2 → 2Fe3+ + 2Cl-.
B. Fe2+ + Mg → Fe + Mg2+.
C. 3Fe2+ + 2Al → 3Fe + 2Al3+.
D. Fe2+ + 2OH- → Fe(OH)2.
Câu 25: Cho m gam bột Fe vào 100 ml dung dịch CuSO4 1M. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch X và 9,2 gam chất rắn Y. Giá trị của m là
A. 5,6. B. 8,4.
C. 11,2. D. 2,8.
Câu 26: Cho m gam một kim loại X tác dụng vừa hết với 2,8 lít (đktc) hỗn hợp gồm Cl2 và O2 có tỉ khối đối với H2 bằng 27,7. Sau phản ứng thu được 18,125 gam chất rắn gồm oxit và muối clorua. X là
A. Fe. B. Cu.
C. Al. D. Zn.
Câu 27: Thực hiện các thí nghiệm sau:
(1) Nung hỗn hợp gồm Fe và NaNO3 trong khí trơ.
(2) Cho luồng khí H2 đi qua bột CuO nung nóng.
(3) Đốt dây Mg trong bình kín chứa đầy khí CO2.
(4) Nhúng dây Ag vào dung dịch HNO3 loãng.
(5) Nung hỗn hợp bột gồm CuO và Al trong khí trơ.
Số thí nghiệm có thể xảy ra phản ứng oxi hóa kim loại là
A. 3. B. 4.
C. 2. D. 5.
Câu 28: Dãy nào sau đây chỉ gồm các kim loại vừa tác dụng với dung dịch HCl, vừa tác dụng với dung dịch NaOH?
A. Al, Zn, Na.
B. Al, Zn, Cr.
C. Ba, Na, Cu.
D. Mg, Zn, Cr.
Câu 29: Cho FeCl2 vào dung dịch AgNO3 dư thu được chất rắn X. Cho X vào dung dịch HNO3 dư thu được dung dịch Y. Giả thiết các phản ứng xảy ra hoàn toàn. Nhận xét nào sau đây đúng?
A. X là Ag.
B. Y chứa một chất rắn.
C. X tan hết trong dung dịch HNO3.
D. X không tan hết trong dung dịch.
Câu 30: Cho m gam Zn vào dung dịch chứa 0,1 mol AgNO3 vào 0,15 mol Cu(NO3)2, sau một thời gian thu được 26,9 gam chất rắn và dung dịch X chứa 2 muối. Tách lấy chất rắn, thêm tiếp 5,6 gam bột sắt vào dung dịch X, sau khi các phản ứng xảy ra hoàn toàn thu được 6 gam chất rắn. Giá trị của m là
A. 6,25.
B. 19,5.
C. 18,25.
D. 19,45.
Bộ 10 đề thi Hóa học lớp 12 học kì 2 năm 2022 tải nhiều nhất – Đề 10
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 12
Thời gian làm bài: 45 phút
(Đề thi số 10)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh:..................................................................... Lớp: .............................
Cho nguyên tử khối của các nguyên tố: F = 19; Cl = 35,5; Br = 80; I = 127; Ag = 108; Li = 7; Na = 23; K = 39; Be = 9; Mg = 12; Ca = 40; Ba = 137; Al = 27; Fe = 56; Cr = 52; Cu = 64; Zn = 65; Mg = 24; O = 16; S = 32.
Câu 1: Cho m gam Mg vào dung dịch chứa 0,12 mol FeCl3. Sau khi phản ứng xảy ra hoàn toàn thu được 3,36 gam chất rắn. Giá trị của m là
A. 2,88. B. 2,16.
C. 4,32. D. 5,04.
Câu 2: Để điều chế kim loại kiềm người ta dùng phương pháp
A. thuỷ luyện.
B. nhiệt luyện.
C. điện phân dung dịch.
D. điện phân nóng chảy.
Câu 3: Oxit nào sau đây là oxit lưỡng tính?
A. Cr2O3. B. CrO.
C. Fe2O3. D. MgO.
Câu 4: Cho x mol Fe tác dụng với dung dịch chứa y mol AgNO3. Để dung dịch sau phản ứng tồn tại các ion Fe3+, Fe2+ thì giá trị của a = y : x là
A. 3 < a < 3,5.
B. 1 < a < 2.
C. 0,5 < a < 1.
D. 2 < a < 3.
Câu 5: Trong các hiện tượng thực hành dưới đây, hiện tượng nào miêu tả không chính xác?
A. Cho mẩu Na vào dung dịch đựng FeCl3 thấy có khí thoát ra đồng thời có kết tủa màu nâu đỏ.
B. Thêm dung dịch NH3 dư vào dung dịch AlCl3 thấy có kết tủa, sục khí CO2 dư vào ống nghiệm chứa kết tủa trên thấy kết tủa tan.
C. Nhúng lá sắt đã đánh sạch gỉ vào dung dịch CuSO4, lá sắt chuyển sang màu đỏ.
D. Thả mẩu kẽm vào hai ống nghiệm đều chứa dung dịch H2SO4. Thêm vào ống nghiệm thứ nhất vài giọt FeSO4 thấy khí thoát ra ở ống nghiệm này nhanh hơn.
Câu 6: Một loại nước cứng có chứa các ion: Ca2+, Mg2+, Cl- và SO42-. Hóa chất nào trong số các chất sau đây có thểm làm mềm loại nước cứng trên?
A. K2CO3. B. NaOH.
C. NaCl. D. KNO3.
Câu 7: Các oxit sau: FeO, MgO, Fe3O4, ZnO những oxit nào phản ứng với HNO3 có tạo ra khí?
A. FeO, Fe3O4.
B. MgO, FeO.
C. Fe3O4, ZnO.
D. MgO, ZnO.
Câu 8: Kim loại nào sau đây khử được ion Fe2+trong dung dịch?
A. Fe.
B. Mg.
C. Na.
D. Cu.
Câu 9: Nhận xét nào sau đây không đúng?
A. Các kim loại kiềm đều mềm và nhẹ.
B. Các kim loại kiềm đều có nhiệt độ nóng chảy rất cao.
C. Các kim loại kiềm đều có tính khử mạnh.
D. Các nguyên tử kim loại kiềm đều có cấu hình electron lớp ngoài cùng là ns1.
Câu 10. Cho hỗn hợp gồm Na và Al tan vào nước thấy hỗn hợp tan hết. Nhận xét đúng là
A. Al tan hoàn toàn trong nước dư.
B. Số mol khí thoát ra bé hơn số mol Al và Na.
C. H2O dư và số mol Al lớn hơn số mol Na.
D. H2O dư và số mol Al bé hơn hoặc bằng số mol Na.
Câu 11. Ion M2+ có cấu hình electron ở lớp ngoài cùng là 3s23p6. Vị trí M trong bảng hệ thống tuần hoàn là
A. Ô 20, chu kì 4, nhóm IIA.
B. Ô 20, chu kì 4, nhóm IIB.
C. Ô 18, chu kì 3, nhóm VIIIA.
D. Ô 18, chu kì 3, nhóm VIIIB.
Câu 12. Tên của các quặng chứa FeCO3, Fe2O3, Fe3O4, FeS2 lần lượt là
A. hematit; pirit; manhetit; xiđerit.
B. xiđerit; manhetit; pirit; hematit.
C. xiđerit; hematit; manhetit; pirit.
D. pirit; hematit; manhetit; xiderit.
Câu 13. Cấu hình electron nào dưới đây được viết đúng?
A. 26Fe: [Ar] 4s13d7.
B. 26Fe2+: [Ar] 4s23d4.
C. 26Fe2+: [Ar] 3d44s2 .
D. 26Fe3+: [Ar] 3d5.
Câu 14. Để khử hoàn toàn 8,0 gam bột Fe2O3 bằng bột Al (ở nhiệt độ cao, trong điều kiện không có không khí) thì khối lượng bột Al cần dùng là
A. 8,10 gam.
B. 1,35 gam.
C. 5,40 gam.
D. 2,70 gam.
Câu 15. Hoà tan hoàn toàn 24,4 gam hỗn hợp gồm FeCl2 và NaCl (có tỉ lệ số mol tương ứng là 1 : 2) vào một lượng nước (dư), thu được dung dịch X. Cho dung dịch AgNO3 (dư) vào dung dịch X, sau khi phản ứng xảy ra hoàn toàn sinh ra m gam chất rắn. Giá trị của m là
A. 57,4. B. 28,7.
C. 10,8. D. 68,2.
Câu 16: Cho 4,9 gam hỗn hợp Fe và Cu (trong đó Cu chiếm 60% khối lượng) vào một lượng dung dịch HNO3 khuấy đều đến phản ứng hoàn toàn thấy còn lại 2,3 gam chất rắn không tan. Khối lượng muối tạo thành là
A. 8,18 g. B. 6,5 g.
C. 10,07 g. D. 8,35 g.
Câu 17: Cho 6,9 gam Na vào dung dịch HCl thu được dung dịch X có chứa 14,59 gam chất tan. Cho dung dịch X vào dung dịch AgNO3 dư đến phản ứng hoàn toàn thu được a gam kết tủa. Giá trị của a là
A. 38,65 gam
B. 28,8 gam
C. 40,76 gam
D. 39,20 gam
Câu 18: Sắt tây là hợp kim của sắt và kim loại M. Kim loại M là
A. Zn. B. Pb.
C. Cr. D. Sn.
Câu 19: Thực hiện các thí nghiệm sau:
(1) Nhúng thanh Fe nguyên chất vào dung dịch hỗn hợp NaNO3 và HCl.
(2) Nhúng thanh Fe nguyên chất vào dung dịch FeCl3.
(3) Nhúng thanh Fe nguyên chất vào dung dịch CuCl2.
(4) Nối thanh nhôm với thanh đồng, để ngoài không khí ẩm.
Số trường hợp xảy ra ăn mòn điện hóa học là
A. 3. B. 1.
C. 2. D. 4.
Câu 20: Chọn phát biểu sai?
A. Cr2O3 là chất rắn màu lục đậm.
B. Cr(OH)3 là chất rắn màu xanh lục.
C. CrO3 là chất rắn màu đỏ thẫm.
D. CrO là chất rắn màu trắng xanh.
Câu 21: Cho các nhận xét sau:
(1) Thép là hợp kim của sắt và cacbon trong đó hàm lượng cacbon chiếm từ 0,01% đến dưới 2%.
(2) Gang là hợp chất của sắt và cacbon trong đó hàm lượng cacbon chiếm từ 2% đến 5%.
(3) Nguyên tắc sản xuất gang là khử oxit sắt thành sắt bằng CO.
(4) Nguyên tắc sản xuất thép là khử cacbon có trong gang.
Số nhận xét đúng là
A. 2. B. 3.
C. 4. D. 1.
Câu 22: Cho dung dịch FeCl3 vào dung dịch chất X, thu được kết tủa Fe(OH)3. Chất X là
A. KOH.
B. NaCl.
C. AgNO3.
D. CH3OH.
Câu 23: Quặng sắt manhetit có thành phần là
A. FeS2
B. Fe3O4
C. FeCO3
D. Fe2O3
Câu 24: Cho 4 nhận xét sau:
(1) Hỗn hợp Na2O + Al2O3 (tỉ lệ mol 1:1) tan hết trong nước dư.
(2) Hỗn hợp Fe2O3 + Cu (tỉ lệ mol 1:1) tan hết trong dung dịch HCl dư.
(3) Hỗn hợp KNO3 + Cu (tỉ lệ mol 1:1) tan hết trong dung dịch H2SO4 loãng, dư.
(4) Hỗn hợp FeS + CuS (tỉ lệ mol 1:1) tan hết trong dung dịch HCl dư.
Số nhận xét đúng là
A. 3.
B. 2.
C. 4.
D. 1.
Câu 25: Hòa tan 9,61 gam hỗn hợp X gồm 3 kim loại Ba, Al và Fe vào nước (lấy dư) thu được 2,688 lít H2 (đkc) và chất rắn Y. Cho Y tác dụng hết với CuSO4 thu được 7,04 gam Cu. Phần trăm khối lượng của Al trong X là
A. 22,47%. B. 33,71%.
C. 28,09%. D. 16,85%.
Câu 26: Cho 17,6 gam hỗn hợp X gồm Fe và Cu phản ứng với dung dịch HCl loãng (dư), đến khi phản ứng xảy ra hoàn toàn thu được 4,48 lít khí H2 (đktc) và dung dịch chứa m gam muối. Giá trị của m là?
A. 25,4 gam. B. 31,8 gam.
C. 24,7 gam D. 18,3 gam
Câu 27: Cho hỗn hợp Fe, Mg vào dung dịch AgNO3 và Cu(NO3)2 thì thu được dung dịch A và 1 kim loại. Kim loại thu được sau phản ứng là
A. Cu. B. Ag.
C. Fe. D. Mg.
Câu 28: Cho các nhận định sau:
(a) Đồng có thể tan trong dung dịch HCl có mặt oxi.
(b) Các kim loại kiềm có thể đẩy Cu2+ ra khỏi dung dịch CuSO4.
(c) Hỗn hợp rắn X gồm KNO3 và Cu (tỉ lệ mol 1:1) hòa tan hết trong dung dịch HCl.
(d) Tất cả các phản ứng của lưu huỳnh với kim loại đều cần đun nóng.
(e) Muối Na2CO3 dễ bị nhiệt phân huỷ.
Số nhận định đúng là
A. 3. B. 2.
C. 4. D. 1.
Câu 29: Nung 20,8 gam hỗn hợp X gồm bột sắt và lưu huỳnh trong bình chân không thu được hỗn hợp Y. Cho toàn bộ Y tác dụng với dung dịch HCl dư, thu được m gam chất rắn không tan và 4,48 lít (ở đktc) hỗn hợp khí Z có tỉ khối so với H2 bằng 9. Giá trị của m là
A. 6,4. B. 16,8.
C. 4,8. D. 3,2.
Câu 30: Hòa tan m gam hỗn hợp FeCl2, FeCl3 và CuCl2 vào nước được dung dịch X. Sục H2S dư vào thấy xuất hiện chất rắn Y nặng 1,28 gam và dung dịch Z. Cho Z tác dụng với dung dịch AgNO3 dư thấy có 22,25 kết tủa. Hòa tan Y trong HNO3 dư thấy thoát ra 1,4 gam khí duy nhất. biết các phản ứng xảy ra hoàn toàn, sản phẩm khử N+5 là NO. Giá trị m gần nhất với
A. 8,4 gam. B. 9,4 gam.
C. 7,8 gam. D. 7,4 gam.