Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh đang trong quá trình ôn tập tài liệu Lý thuyết về hóa học lớp 12 chi tiết, chọn lọc môn Hóa học lớp12, tài liệu bao gồm 34trang, đầy đủ lý thuyết, phương pháp giải chi tiết và bài tập có đáp án (có lời giải), giúp các em học sinh có thêm tài liệu tham khảo trong quá trình ôn tập, củng cố kiến thức và chuẩn bị cho bài thi môn Hóa học sắp tới. Chúc các em học sinh ôn tập thật hiệu quả và đạt được kết quả như mong đợi.
Mời các quý thầy cô và các em học sinh cùng tham khảo và tải về chi tiết tài liệu dưới đây:
TÓM TẮT LÝ THUYẾT HÓA HỌC 12
CHƯƠNG I: ESTE - LIPIT
A- ESTE
I. Khái niệm, danh pháp :
1. Khái niệm :
- Khi thay nhóm -OH trong nhóm -COOH của axit cacboxylic bằng nhóm –OR’ ta được este.
Công thức este đơn chức : RCOOR’ ( )
Công thức este no,đơn chức : CaH2a+1COOCbH2b+1
hay CnH2nO2
2. Danh pháp :
|
Tên este = tên gốc hidrocacbon R’ + tên gốc axit RCOO |
VD :
HCOOCH3……………metyl fomat CH2=CH-COOCH3…………metyl acrylat
Viết CTCT và gọi tên các este có CTPT là :
a.C2H4O2 có 1 đp este:
. HCOO-CH3………….…metyl fomat
b.C3H6O2 có 2 đp este:
. HCOO-C2H5……………etyl fomat CH3-COO-CH3 ….……..….metyl axetat
c. C4H8O2 có 4 đp este :
. HCOO-CH2-CH2-CH3…propyl fomat HCOO-CH-CH3………...….iso propyl fomat
CH3
. CH3COOC2H5…………etyl axetat. C2H5COOCH3…….………..metyl propionat
II. Tính chất vật lí :
- Đk thường là chất lỏng hoặc rắn.
- Nhẹ hơn nước rất ít tan trong nước
- Nhiệt độ sôi và độ tan trong nước thấp hơn axit hoặc ancol có có khối lượng phân tử tương đương hoặc cùng số Cacbon vì : giữa các phân tử este không tạo được liên kết hidro và liên kết hidro giữa các phân tử este với các phân tử nước rất kém.
- Có mùi thơm đặc trưng :
. iso amyl axetat : CH3COOCH2CH2CH(CH3)2 mùi chuối chín
. benzyl axetat : CH3COO-CH2-C6H5 mùi hoa nhài
. etyl propionat : CH3-CH2-COO-CH2-CH3 mùi dứa
III. Tính chất hóa học :
1. Pư cháy :
CnH2nO2 + O2 nCO2 + nH2O
2. Pư thủy phân trong môi trường axit :
R–COO–R’ + H2O R–COOH + R’–OH
3. Pư thủy phân trong môi trường kiềm : Pư xà phòng hóa
R–COO–R’ + NaOH → R–COONa + R’–OH
4. Pư ở gốc hidrocacbon :
HCOOR + AgNO3 + NH3 + H2O → 2Ag
CH2=CH-COOR + Br2 → CH2Br – CHBr – COOR
CH2=CH-COOR + H2 → CH3 – CH2 – COOR
COOCH3
CH2=C-COOCH3 (-CH2-C-)
CH3 CH3
Metyl metacrylat thủy tinh hữu cơ
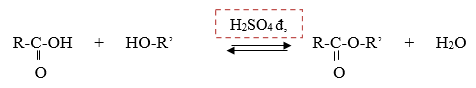
IV. Điều chế :
1. Este no, đơn :
R – C–OH + R’-OH → R-C-O-R’ + H2O
O O
2. Este không no :
R – COOH + CHCH → R –COO–CH=CH2
V. Ứng dụng :
Làm dung môi, sx bánh kẹo, nước hoa, mĩ phẩm, keo dán, thủy tinh hữu cơ, xà phòng, chất giặt rửa.
B- LIPIT
I. Khái niệm : lipit là những hợp chất hữu cơ có trong tế bào sống, không hòa tan trong nước nhưng lại tan nhiều trong dung môi hữu cơ không phân cực.Lipit là các este phức tạp gồm chất béo, sáp, steroid, photpholipit…
II. Chất béo :
1. Khái niệm: là tri este của glixerol và các axit béo (axit monocacboxylic có số C >=16 không phân nhánh) gọi là triglixerit
CT chung:
2. Phân loại:
Chất béo không no (dầu) : sản phẩm của axit béo không no
Chất béo no (mỡ) : sản phẩm của axit béo no
Các axit béo thường gặp :
+ Axit stearic : C17H35COOH (no, đơn)
+Axit panmitic : C15H31COOH (no, đơn)
+Axit oleic : C17H33COOH (không no, có một nối đôi)
+Axit linoleic : C17H31COOH (không no, có hai nối đôi)
3. Tính chất hóa học:
a) Phản ứng thủy phân:
+ Trong môi trường axit:
Đặc điểm phản ứng:
- Sản phẩm: axit và glixerol
- Là phản ứng thuận nghịch [ tăng nhiệt, thêm axit, thêm nước để tăng tốc độ phản ứng
+ Phản ứng xà phòng hóa:
Đặc điểm phản ứng:
- Sản phẩm: muối và glixerol
- Là phản ứng một chiều
- nNaOH = 3.nglixerol
b) Phản ứng cộng với H2 (đối với chất béo không no):
VD: (C17H33COO)3C3H5 + 3H2 → (C17H35COO)3C3H5
III. Ứng dụng :
Điều chế xà phòng, glixerol, chế biến thực phẩm…
Lưu ý :
Ø CHỈ SỐ AXIT BÉO : số mg KOH cần dùng để trung hòa 1g chất béo
Ø CHỈ SỐ XÀ PHÒNG HÓA : số mg KOH cần dùng để xà phòng hóa 1g chất béo
Ø CHỈ SỐ IOT : số g Iot có thể kết hợp với 100g chất béo
Chương II : CACBOHIDRAT (GLUXIT)
Định nghĩa : Cacbonhidrat là những hợp chất hữu cơ tạp chức, đa số có công thức chung là Cn(H2O)m
Phân loại :
Monosaccarit : là nhóm cacbohidrat đơn giản nhất, không thể thủy phân được : glucozo, fructozo.
Đisaccarit : là nhóm cacbohidrat khi thủy phân mỗi phân tử sinh ra 2 phân tử monosaccarit : saccarozo, mantozo.
Polisaccarit : là nhóm cacbohidrat phức tạp, khi thủy phân đến cùng mỗi phân tử sinh ra nhiều phân tử monosaccarit : tinh bột, xenlulozo.
A- GLUCOZO (đường nho) C6H12O6 M = 180
I. Tính chất vật lí, trạng thái tự nhiên :
- Chất rắn, không màu, tan nhiều trong nước , có vị ngọt ( kém đường mía)
- Có trong các bộ phận của cây, trong mật ong chứa 30%, trong máu chứa 0,1%
II. Cấu tạo phân tử : CH2OH-[CHOH]4-CH=O
Tồn tại chủ yếu ở dạng mạch vòng : ![]()
ð Pư chứng tỏ glucozo tồn tại ở dạng mạch vòng là : CH3OH/HCl
III. Tính chất hóa học :
1. Tính chất của ancol đa chức :
· Tác dụng với kết tủa Cu(OH)2 tạo dd xanh thẫm :
2C6H12O6 + Cu(OH)2 → (C6H11O6)2 Cu + 2H2O
· Tác dụng với anhidrit axit tạo este :
C6H12O6 + 5(CH3CO)2O → C6H7O(OCOCH3)5 + 5CH3COOH
2. Tính chất của andehit :
· Tác dụng với H2/Ni,to :
CH2OH[CHOH]4CHO + H2 → CH2OH[CHOH]4CH2OH Sobit / Sorbitol
· Tác dụng với dd AgNO3 trong NH3 :
CH2OH[CHOH]4CHO + 2AgNO3 +3NH3 + H2O → CH2OH[CHOH]4COONH4 + 2Ag + 2NH4 NO3
Amoni gluconat
Hiện tượng: xuất hiện lớp bạc bám vào thành ống nghiệm
· Tác dụng với dd Br2 :
CH2OH[CHOH]4CHO + Br2 → CH2OH[CHOH]4COOH + HBr
Hiện tượng: mất màu dung dịch Brom
· Tác dụng với Cu(OH)2/NaOH ở nhiệt độ cao :
CH2OH[CHOH]4CHO + Cu(OH)2 + NaOH → CH2OH[CHOH]4COONa + Cu2O$ + 3H2O
Natri gluconat
Hiện tượng: xuất hiện kết tủa đỏ gạch
3. Tính chất riêng :
C6H12O6 → 2C2H5OH + 2CO2
C6H12O6 → 2CH3-CH(OH)-COOH axit lactic
IV. Điều chế :
(C6H10O5)n + nH2O → nC6H12O6
V. Ứng dụng :
Làm thuốc tăng lực, vitamin C, pha huyết thanh
Trong công nghiệp : tráng ruột phích, tráng gương, sx rượu etylic
VI. Đồng phân : FRUCTOZO
CTCT CH2 – CH – CH – CH – C – CH2
OH OH OH OH O OH
Fructozo có tính chất hh tương tự glucozo:
Fructozo Glucozo
Nhận biết fructozo và glucozo : dùng dd Br2
B- SACCAROZO, TINH BỘT, XENLULOZO
I. Saccarozo : C12H22O11 ( đường mía)
1. Tính chất vật lí :
Chất rắn kết tinh, không màu, vị ngọt, dễ tan trong nước.
2. Cấu tạo phân tử :
Gồm 1 nhóm và 1 nhóm liên với với nhau qua nguyên tử oxi
à không có nhóm –CHO trong phân tử (không có tính khử)
3. Tính chất hóa học :
· Không có pư tráng bạc, không tham gia pư với dd Br2
· Không khử Cu(OH)2/NaOH ở nhiệt độ cao
· Tác dụng với Cu(OH)2 tạo dd xanh thẫm :
2C12H22O11 + Cu(OH)2 → (C12H21O11)2 Cu + 2H2O
· Tác dụng với Ca(OH)2 (vôi sữa) : vôi sữa tan hết; dẫn khí CO2 vào dd đục trở lại.
4. Pư thủy phân : C12H22O11 sacarozo + H2O → C6H12O6 glucozo + C6H12O6 fructozo
5. Ứng dụng :
Làm thức ăn; sx bánh kẹo, nước giải khát; sx thuốc viên, thuốc nước ; sx gương soi, phích.
6. Đồng phân : MANTOZO
Gồm 2 gốc liên kết với nhau qua nguyên tử oxi.
à có nhóm –CHO trong phân tử (có tính khử)
è tham gia tất cả phản ứng giống glucozo
è để nhận biết saccarozo và mantozo ta dùng dd Brom.
C12H22O11 mantozo + H2O → 2C6H12O6 glucozo
II. Tinh bột :
1. Tính chất vật lí :
Chất rắn (bột) vô định hình, màu trắng, không tan trong nước lạnh
Tan trong nước nóng tạo hồ tinh bột.
2. Cấu trúc phân tử :
Gồm nhiều gốc liên kết với nhau tạo thành 2 dạng : amilozo (cấu tạo mạch không phân nhánh) và amilopectin (cấu tạo mạch phân nhánh).
3. Tính chất hóa học :
a. Pư thủy phân :
(C6H10O5)n + nH2O → nC6H12O6 glucozo
b. Pư màu với Iot :
Hồ tinh bột + dd I2 à có màu xanh tím
è để nhận biết : dùng hồ tinh bột
III. Xenlulozo :
1. Tính chất vật lí :
Chất rắn, dạng sợi, màu trắng, không mùi vị, không tan trong nước và các dung môi nhưng tan trong dd Svayde [ Cu(OH)2 + NH3]
2. Cấu trúc phân tử :
Gồm nhiều gốc liên kết với nhau.
3. Tính chất hóa học :
· Pư thủy phân :
(C6H10O5)n + nH2O → nC6H12O6 glucozo
· Pư với axit nitric :
[C6H7O2(OH)3]n + 2nHNO3 → [C6H7O2(ONO2)2OH]n + 2n H2O
Xenlulozo đinitrat
[C6H7O2(OH)3]n + 3nHNO3 → [C6H7O2(ONO2)3]n + 3n H2O
Xenlulozo trinitrat
· Pư với anhidrit axetic :
[C6H7O2(OH)3]n + 2n(CH3CO)2O → [C6H7O2(OCOCH3)2OH]n + 2n CH3COOH
Xenlulozo điaxetat
[C6H7O2(OH)3]n + 3n(CH3CO)2O → [C6H7O2(OCOCH3)3]n + 3n CH3COOH
Xenlulozo triaxetat
4. Ứng dụng :
Sx giấy, điều chế tơ nhân tạo như tơ visco, tơ axetat, chế tạo thuốc súng không khói…
Chương III : AMIN, AMINOAXIT VÀ PROTEIN
A- AMIN
I. Khái niệm, phân loại :
1. Khái niệm :
Amin là dẫn xuất của ammoniac khi thay thế nguyên tử H trong phân tử NH3 bằng gốc hidrocacbon.
CTTQ : amin đơn chức CxHyN
Amin no, đơn chức CnH2n+3N
Amin no, đơn chức, bậc I CnH2n+1NH2
2. Phân loại : theo 2 cách
· Theo gốc hidrocacbon :
Ø Amin mạch hở : CH3NH2 ; C2H5NH2 ; CH2=CH–CH2–NH2…
Ø Amin thơm : C6H5NH2 ; C6H5CH2NH2…
· Theo bậc amin :
Ø Amin bậc 1 : R – NH2
Ø Amin bậc 2 : R – NH – R’
Ø Amin bậc 3 : R – N – R’
R’’
II. Đồng phân , danh pháp :
1. Đồng phân : [Cách dễ nhất là viết theo bậc amin]
Công thức tính số đồng phân của amin no, đơn :
* Viết đồng phân amin của chất có công thức :
· C3H9N
CH3– CH2–CH2– NH2…… propylamin CH3– CH(CH3)– NH2……isopropylamin
CH3– CH2– NH– CH3........ etylmetylamin CH3– N – CH3…………..trimetylamin
CH3
· C4H11N
CH3– CH2–CH2– CH2–NH2……butylamin CH3– N– CH2 – CH3……đimetyletyl amin
CH3– CH2–CH(CH3)– NH2 ……sec butyl amin CH3
CH3–CH(CH3) – CH2– NH2……iso butyl amin
CH3–C(CH3)2– NH2 ……………tert bytyl amin CH3–CH2– CH2– NH– CH3……metylpropyl amin
CH3–CH(CH3)– NH– CH3……..metylisopropyl amin CH3–CH2– NH– CH2– CH3……đimetyl amin
2. Danh pháp :
· Tên gốc chức :
|
Số chỉ vị trí nhánh + tên nhánh + ank + yl |
+ amin |
· Tên thay thế :
|
Ankan + vị trí |
+ amin |
v Một số amin đặc biệt :
· Anilin (phenyl amin) : C6H5NH2 chất lỏng không màu, ít tan trong nước,nặng hơn nước
· Allyl amin : CH2=CH–CH2–N H2
· Benzyl amin : C6H5CH2NH2
· m- toluidin ; o- toluidin ; p-toluidin : CH3C6H4NH2
III.Tính chất vật lí :
· Metyl amin, đimetyl amin, trimetyl amin, etyl amin : là chất khí, mùi khai , tan nhiều trong nước.
· Nhiệt độ sôi tăng dần, độ tan trong nước giảm dần theo chiều tăng của phân tử khối.
· Trong không khí các amin thơm bị oxi hóa, chuyển từ không màu sang màu đen.
· Các amin đều độc.
IV. Tính chất hóa học :
1. Tính bazo :
R–NH2 + H2O → R–NH3+ + OH -
Lực bazo phụ thuộc vào gốc hidrocacbon :
C6H5NH2 < NH3 < CH3NH2 < C2H5NH2
(Càng nhiều vòng càng yếu, càng nhiều C mạch hở càng mạnh)
Nhúng giấy quỳ vào dd metylamin, etyl amin, propyl amin : giấy quỳ hóa xanh
Nhúng giấy quỳ vào dd anilin : giấy quỳ không đổi màu.
v Tác dụng với axit :
CH3NH2 + HCl → CH3NH3Cl
C2H5NH2 + HCl → C2H5NH3Cl
Hiện tượng : xuất hiện khói trắng
C6H5NH2 + HCl → C6H5NH3Cl
Hiện tượng : anilin tan dần
à pư để nhận biết amin mạch hở và amin thơm
v Amin hay anilin đều là các bazo yếu nên dễ dàng bị bazo mạnh hơn đẩy ra khỏi dd muối
CH3NH3Cl + NaOH → CH3NH2 + NaCl + H2O
2. Tính chất của nhân thơm : Pư thế ở nhân thơm của anilin
C6H5NH2 + 3Br2 → C6H2NH2Br3 + 3HBr
Hiện tượng : xuất hiện kết tủa trắng à pư để nhận biết anilin
3. Tác dụng với dd muối : ( nguyên tử từ C1à C3)
3RNH2 + FeCl3 + 3H2O → 3RNH3Cl + Fe(OH)3
4. Tác dụng với axit nitrơ : (Amin bậc 1 )
R–NH2 + HNO2 → R–OH + N2 + H2O
5. Pư cháy :
CnH2n+3N + O2 → nCO2 + H2O + N2
V. Điều chế :
R–X + NH3 → R–NH2 + HX
R–NH2 + R’–X → R–NH –R’ + HX
R–NH – R’ + R’–X → R–N –R’ + HX
R’’
R–OH + NH3 → R–NH2 + H2O
R–NO2 + 3Fe + 6HCl → R–NH2 + 3FeCl2 + 2H2O
. Điều chế anilin :
C6H6 + HNO3 → C6H5NO2 + H2O
C6H5NO2 + 3Fe + 6HCl → C6H5–NH2 + 3FeCl2 + 2H2O









