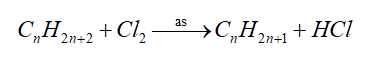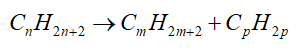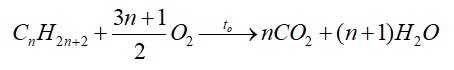Với giải Luyện tập trang 71 Hóa học lớp 11 Chân trời sáng tạo chi tiết trong Bài 12: Alkane giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 11. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 11 Bài 12: Alkane
Luyện tập trang 71 Hóa học 11: Theo Ví dụ 5, nếu lấy cùng khối lượng methane và propane, chất nào toả ra nhiều nhiệt hơn?
Lời giải:
Giả sử khối lượng methane và propane được lấy bằng nhau và bằng 100 gam.
Ta có:
CH4(g) + 2O2(g) CO2(g) + 2H2O(g)
Dựa vào phương trình nhiệt học ta thấy:
Đốt cháy 1 mol CH4 giải phóng 890 kJ nhiệt lượng.
Đốt cháy 6,25 mol CH4 giải phóng 6,25.890 = 5562,5 kJ nhiệt lượng.
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
Dựa vào phương trình nhiệt học ta thấy:
Đốt cháy 1 mol C3H8 giải phóng 2219 kJ nhiệt lượng.
Đốt cháy mol C3H8 giải phóng nhiệt lượng.
Vậy nếu lấy cùng một khối lượng, đốt cháy methane toả nhiều nhiệt lượng hơn.
Lý thuyết Tính chất hóa học
- Phản ứng thế halogen
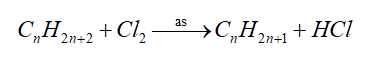
=> Phản ứng đặc trưng của alkane, nguyên tử H liên kết với nguyên tử C bậc cao dễ bị thế hơn nguyên tử H liên kết với nguyên tử C bậc thấp hơn.
- Phản ứng cracking: quá trình “bẻ gãy” các phân tử alkane mạch dài thành các phân tử hydrocarbon mạch ngắn hơn.
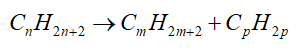
- Phản ứng reforming: quá trình biển đổi cấu trúc phân tử các alkane mạch không phân nhánh, mạch hở, không thơm thành các hydrocarbon có mạch nhánh hoặc mạch vòng.
- Phản ứng oxi hóa
+ Oxi hóa hoàn toàn: các alkane thường dễ cháy và tỏa nhiều nhiệt.
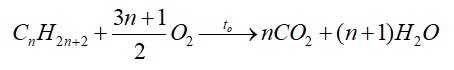
+ Oxi hóa không hoàn toàn: trong trường hợp thiếu oxygen, phản ứng cháy xảy ra không hoàn toàn, tạo CO và có thể có C.
Xem thêm lời giải bài tập Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Mở đầu trang 66 Hóa học 11: Gas dùng làm nhiên liệu đun nấu trong gia đình có thành phần chủ yếu là propane và butane. Đây là các alkene ở thể khí trong điều kiện thường nhưng được hoá lỏng dưới áp suất cao....
Câu hỏi thảo luận 1 trang 67 Hóa học 11: Vì sao methane được gọi là khí hồ ao?...
Câu hỏi thảo luận 2 trang 67 Hóa học 11: Hãy nêu nhận xét đặc điểm cấu tạo phân tử của các alkane. Vì sao alkane còn được gọi là hydrocarbon bão hoà hay hydrocarbon no?...
Luyện tập 1 trang 67 Hóa học 11: Alkane nào dưới đây có mạch phân nhánh?...
Luyện tập 2 trang 67 Hóa học 11: Phân tử của một alkane trong sáp nến có 52 nguyên tử hydrogen. Xác định số nguyên tử carbon trong phân tử alkane nói trên....
Câu hỏi thảo luận 3 trang 68 Hóa học 11: Dựa vào thông tin nào trong Bảng 12.1 để chứng minh 4 chất đầu dãy đồng đẳng alkane đều ở thể khí?...
Luyện tập 1 trang 68 Hóa học 11: Gọi tên các gốc alkyl sau: CH3 – , C2H5 – và CH3CH2CH2 –....
Luyện tập 2 trang 68 Hóa học 11: Viết công thức cấu tạo và đọc tên tất cả các đồng phân alkane có công thức phân tử C5H12....
Câu hỏi thảo luận 4 trang 69 Hóa học 11: Khi số nguyên tử carbon tăng, thể tích của các phân tử alkane chuyển từ khí sang lỏng, rồi rắn. Giải thích....
Vận dụng trang 69 Hóa học 11: Vì sao người ta thường dùng xăng để rửa sạch các vết bẩn dầu mỡ?...
Câu hỏi thảo luận 5 trang 69 Hóa học 11: Những nguyên tử carbon trong phân tử alkane không phân nhánh có nằm trên cùng một đường thẳng không? Giải thích....
Câu hỏi thảo luận 6 trang 70 Hóa học 11: Giải thích hiện tượng xảy ra trong hai ống nghiệm ở Thí nghiệm 1....
Câu hỏi thảo luận 7 trang 70 Hóa học 11: Khi cho methane tác dụng với chlorine (có chiếu sáng hoặc đun nóng), các nguyên tử hydrogen trong methane lần lượt bị thay thế bởi các nguyên tử chlorine, tạo ra 4 dẫn xuất chloro khác nhau. Viết phương trình hoá học của phản ứng xảy ra....
Luyện tập trang 70 Hóa học 11: Cho 2 – methylbutane tác dụng với chlorine trong điều kiện chiếu sáng thu được tối đa bao nhiêu đồng phân cấu tạo dẫn xuất monochloro?...
Câu hỏi thảo luận 8 trang 70 Hóa học 11: Viết 3 phương trình hoá học khác nhau khi cracking decane (C10H22)....
Luyện tập trang 71 Hóa học 11: Theo Ví dụ 5, nếu lấy cùng khối lượng methane và propane, chất nào toả ra nhiều nhiệt hơn?...
Câu hỏi thảo luận 9 trang 71 Hóa học 11: Quan sát, nhận xét màu ngọn lửa và viết phương trình hoá học của phản ứng đốt cháy hexane....
Câu hỏi thảo luận 10 trang 71 Hóa học 11: Sau Bước 2 của Thí nghiệm 3, so sánh hiện tượng xảy ra giữa 2 ống nghiệm....
Câu hỏi thảo luận 11 trang 72 Hóa học 11: Nguyên nhân nào đã làm ra tăng khói thải và các hạt bụi mịn vào không khí?...
Luyện tập trang 73 Hóa học 11: Bụi mịn PM2.5 là các hạt bụi có đường kính nhỏ hơn hoặc bằng 2,5 μm. Chúng lơ lửng trong không khí và được hình thành từ các nguyên tố như C, S, N cùng các hợp chất kim loại khác. Cho biết tác hại của bụi mịn PM2.5 đến sức khoẻ....
Vận dụng trang 73 Hóa học 11: Em hãy đề xuất một số giải pháp để hạn chế tình trạng ô nhiễm không khí hiện nay.....
Bài 1 trang 73 Hóa học 11: Quan sát biểu đồ thể hiện nhiệt độ sôi của bốn alkane đầu tiên...
Bài 2 trang 73 Hóa học 11: Biết rằng thành phần chủ yếu của xăng dầu là hydrocarbon. Hãy giải thích vì sao:...
Bài 3 trang 73 Hóa học 11: Alkane X có công thức phân tử C5H12. Xác định công thức cấu tạo và gọi tên alkane X, biết X chỉ có thể tạo ra một dẫn xuất monochloro duy nhất....
Xem thêm các bài giải SGK Hóa lớp 11 Chân trời sáng tạo hay, chi tiết khác: