Lời giải bài tập Hóa học lớp 11 Bài 12: Alkane sách Chân trời sáng tạo hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 11 Bài 12 từ đó học tốt môn Hóa 11.
Giải bài tập Hóa học lớp 11 Bài 12: Alkane
Alkane là gì? Chúng có vai trò như thế nào trong đời sống và sản xuất?
Lời giải:
- Alkane là những hydrocarbon mạch hở chỉ chứa liên kết đơn trong phân tử và có công thức chung CnH2n + 2 (n ≥ 1).
- Alkane được sử dụng làm nhiên liệu, dung môi, dầu nhờn, … và nguyên liệu để tổng hợp các chất hữu cơ khác nhau.
1. Khái niệm về alkane
Câu hỏi thảo luận 1 trang 67 Hóa học 11: Vì sao methane được gọi là khí hồ ao?
Lời giải:
Methane còn được gọi là khí hồ ao vì methane được tìm thấy trong sự phân huỷ kị khí ở các ao hồ, đầm lầy …
Lời giải:
- Đặc điểm cấu tạo: Phân tử alkane chỉ chứa các liên kết đơn.
- Alkane còn được gọi là hydrocarbon bão hoà hay hydrocarbon no do phân tử chỉ chứa các liên kết đơn.
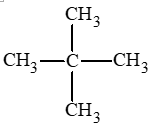
Luyện tập 1 trang 67 Hóa học 11: Alkane nào dưới đây có mạch phân nhánh?
Lời giải:
Alkane có mạch phân nhánh là: (b).
Lời giải:
Công thức chung của alkane: CnH2n + 2.
Do alkane có 52 nguyên tử hydrogen nên 2n + 2 = 52 n = 25.
Vậy alkane này có 25 nguyên tử carbon.
2. Danh pháp alkane
Lời giải:
Dựa vào thông tin nhiệt độ sôi, nhiệt độ nóng chảy nhỏ hơn 0 oC chứng minh được 4 chất đầu dãy đồng đẳng alkane ở thể khí.
Luyện tập 1 trang 68 Hóa học 11: Gọi tên các gốc alkyl sau: CH3 – , C2H5 – và CH3CH2CH2 –.
Lời giải:
CH3 – : methyl;
C2H5 –: ethyl;
CH3CH2CH2 –: propyl.
Lời giải:
Các đồng phân alkane có công thức phân tử C5H12:
CH3 – CH2 – CH2 – CH2 – CH3: pentane.
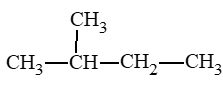
3. Tính chất vật lí
Lời giải:
Khi số nguyên tử carbon tăng, thể tích của các phân tử alkane chuyển từ khí sang lỏng, rồi rắn do:
+ Khối lượng phân tử alkane tăng dần theo chiều tăng của số nguyên tử carbon;
+ Tương tác van der Waals giữa các phân tử alkane tăng.
Vận dụng trang 69 Hóa học 11: Vì sao người ta thường dùng xăng để rửa sạch các vết bẩn dầu mỡ?
Lời giải:
Xăng chủ yếu chứa các alkane ở thể lỏng. Do các phân tử alkane trong xăng không phân cực nên có thể hoà tan tốt dầu mỡ (là các chất kém phân cực).
4. Tính chất hóa học
Lời giải:
- 2 nguyên tử carbon trong phân tử ethane (C2H6) cùng nằm trên một đường thẳng.
- Với các alkane mạch thẳng có số C > 3, những nguyên tử carbon của các alkane này không nằm trên cùng một đường thẳng. Do các nguyên tử C alkane ở trạng thái lai hoá sp3. Mỗi nguyên tử C nằm ở tâm của tứ diện mà 4 đỉnh là các nguyên tử H hoặc C; các góc hoá trị đều gần bằng 109,5o.
Ví dụ mô hình phân tử một số alkane:
Lời giải:
- Hiện tượng:
+ Ban đầu các ống nghiệm có hai lớp, lớp dưới là bromine màu vàng, lớp trên là hexane không màu.
Sau khi lắc đều:
+ Ống nghiệm để nơi có ánh sáng mặt trời (hoặc ngâm trong cốc nước nóng) nhạt màu dần đến mất màu;
+ Ống nghiệm không để ở nơi có ánh sáng mặt trời tách thành hai lớp; lớp trên là hỗn hợp bromine và hexane còn lớp dưới là nước.
- Giải thích:
+ Khi có mặt của ánh sáng khuếch tán hoặc khi đun nóng, các alkane tham gia phản ứng thế với halogen (chlorine, bromine).
+ Với ống nghiệm không để ngoài ánh sáng không xảy ra phản ứng thế, chỉ có sự hoà tan vật lí bromine vào hexane.
Lời giải:
Các phương trình hoá học của phản ứng xảy ra:
CH4 + Cl2 CH3Cl + HCl
CH3Cl + Cl2 CH2Cl2 + HCl
CH2Cl2 + Cl2 CHCl3 + HCl
CHCl3 + Cl2 CCl4 + HCl.
Lời giải:
Cho 2 – methylbutane tác dụng với chlorine trong điều kiện chiếu sáng thu được tối đa 4 dẫn xuất monochloro là:
CH2Cl – CH(CH3) – CH2 – CH3;
CH3 – CCl(CH3) – CH2 – CH3;
CH3 – CH(CH3) – CHCl – CH3;
CH3 – CH(CH3) – CH2 – CH2Cl.
Lời giải:
C10H22 C3H6 + C7H16.
C10H22 C4H8 + C6H14.
C10H22 C5H10 + C5H12.
Lời giải:
Giả sử khối lượng methane và propane được lấy bằng nhau và bằng 100 gam.
Ta có:
CH4(g) + 2O2(g) CO2(g) + 2H2O(g)
Dựa vào phương trình nhiệt học ta thấy:
Đốt cháy 1 mol CH4 giải phóng 890 kJ nhiệt lượng.
Đốt cháy 6,25 mol CH4 giải phóng 6,25.890 = 5562,5 kJ nhiệt lượng.
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
Dựa vào phương trình nhiệt học ta thấy:
Đốt cháy 1 mol C3H8 giải phóng 2219 kJ nhiệt lượng.
Đốt cháy mol C3H8 giải phóng nhiệt lượng.
Vậy nếu lấy cùng một khối lượng, đốt cháy methane toả nhiều nhiệt lượng hơn.
Lời giải:
Hexane bốc cháy cho ngọn lửa màu vàng.
Phương trình hoá học của phản ứng:
Lời giải:
Dung dịch thuốc tím trong cả hai ống nghiệm đều không bị mất màu.
5. Ứng dụng của alkane và điều chế alkane trong công nghiệp
Lời giải:
Nguyên nhân làm gia tăng khói thải và các hạt bụi mịn vào không khí:
+ Khí thải do các phương tiện giao thông hoạt động thải ra trong quá trình đốt cháy nhiên liệu.
+ Khí thải do đốt cháy các nhiên liệu trong các nhà máy nhiệt điện, khu công nghiệp …
Lời giải:
Tác hại của bụi mịn PM2.5 đến sức khoẻ: PM2.5 là nguyên nhân gây nhiễm độc máu, máu khó đông khiến hệ tuần hoàn bị ảnh hưởng, làm suy nhược hệ thần kinh điều khiển hoạt động của cơ tim gây ra các bệnh tim mạch. Những hạt bụi mịn xâm nhập vào cơ thể, làm giảm chức năng của phổi, viêm phế quản mãn tính, gây nên bệnh hen suyễn và ung thư phổi.
Lời giải:
Một số biện pháp hạn chế tình trạng ô nhiễm hiện nay:
- Sử dụng các phương tiện công cộng thay cho phương tiện cá nhân.
- Giảm bớt lượng chì (lead) có trong nhiên liệu.
- Tăng hiệu suất đốt cháy nhiên liệu động cơ.
- Đưa thêm chất xúc tác vào ống xả động cơ nhằm tiếp tục chuyển hoá alkane trong khí thải động cơ thành carbon dioxide và nước.
- Trồng nhiều cây xanh….
Bài tập (trang 73)
Bài 1 trang 73 Hóa học 11: Quan sát biểu đồ thể hiện nhiệt độ sôi của bốn alkane đầu tiên.
a) Nhận xét và giải thích sự biến đổi nhiệt độ sôi của các alkane đã cho trong biểu đồ.
b) Ở nhiệt độ phòng, methane, ethane, propane và butane là những chất lỏng hay chất khí?
Lời giải:
a) Nhiệt độ sôi của 4 alkane đầu tiên tăng theo chiều tăng của số nguyên tử carbon.
Giải thích: Khi số nguyên tử carbon tăng, tương tác van der Waals giữa các phân tử alkane tăng, dẫn đến nhiệt độ sôi của các alkane cũng tăng.
b) Ở nhiệt độ phòng methane, ethane, propane và butane là những chất khí.
a) phải chứa xăng, dầu trong các thùng chứa chuyên dụng và bảo quản ở những kho riêng.
b) các sự cố tràn dầu trên biển thường gây ra thảm hoạ cho một vùng biển rất rộng.
c) khi bị cháy xăng dầu không nên dùng nước để dập đám cháy.
Lời giải:
a) Do xăng, dầu dễ bắt lửa, dễ cháy và khi cháy toả ra lượng nhiệt lớn nên phải chứa xăng, dầu trong các thùng chứa chuyên dụng và bảo quản ở những kho riêng.
b) Do xăng, dầu nhẹ hơn nước, không tan trong nước nên nổi trên mặt nước do tác động sóng biển và thủy triều các váng xăng, dầu lan rộng làm các sinh vật biển nhiễm độc hoặc chết hàng loạt … Do đó các sự cố tràn dầu trên biển thường gây ra thảm hoạ cho một vùng biển rất rộng.
c) Không được dùng nước để dập đám cháy gây ra do xăng dầu. Bởi vì xăng dầu nhẹ hơn nước, nếu ta dập đám cháy gây ra bởi xăng dầu bằng nước thì nước lan tỏa đến đâu xăng dầu lan tỏa đến đó khiến đám cháy còn lan rộng lớn và khó dập tắt hơn.
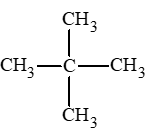
Lời giải:
Alkane có công thức phân tử C5H12, khi tác dụng với chlorine chỉ tạo ra một dẫn xuất monochloro duy nhất → alkane này có tính đối xứng cao.
Vậy alkane thoả mãn là:
Lý thuyết Alkane
1. Khái niệm về alkane
- Alkane là những hydrocarbon mạch hở chỉ chứa liên kết đơn trong phân tử và có công thức chung là CnH2n+2 (n1).
- Nguồn alkane trong tự nhiên: dầu mỏ, khí dầu mỏ, khí ao hồ.
2. Danh pháp
- Tên theo danh pháp thay thế của alkane không phân nhánh:
Tiền tố ứng với số nguyên tử carbon của alkane + ane
-Tên theo danh pháp thay thế của alkane phân nhánh
Số chỉ vị trí nhánh-Tên nhánh + Tiền tố ứng với số nguyên tử carbon mạch chính + ane
3. Tính chất vật lý
- Ở điều kiện thường, các alkane từ C1 đến C4 ở thể khí.
- Các alkane đều nhẹ hơn hơn nước, không tan truong nước, nhưng tan trong các dung môi không phân cực.
- Khi số nguyên tử carbon tăng, nhiệt độ sôi và nhiệt độ nóng chảy của các alkane tăng.
4. Tính chất hóa học
- Phản ứng thế halogen
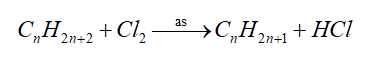
=> Phản ứng đặc trưng của alkane, nguyên tử H liên kết với nguyên tử C bậc cao dễ bị thế hơn nguyên tử H liên kết với nguyên tử C bậc thấp hơn.
- Phản ứng cracking: quá trình “bẻ gãy” các phân tử alkane mạch dài thành các phân tử hydrocarbon mạch ngắn hơn.
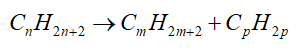
- Phản ứng reforming: quá trình biển đổi cấu trúc phân tử các alkane mạch không phân nhánh, mạch hở, không thơm thành các hydrocarbon có mạch nhánh hoặc mạch vòng.
- Phản ứng oxi hóa
+ Oxi hóa hoàn toàn: các alkane thường dễ cháy và tỏa nhiều nhiệt.
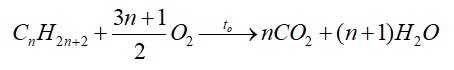
+ Oxi hóa không hoàn toàn: trong trường hợp thiếu oxygen, phản ứng cháy xảy ra không hoàn toàn, tạo CO và có thể có C.
5. Ứng dụng của alkane và điều chế alkane trong công nghiệp
- Alkane được sử dụng làm nhiên liệu, dung môi, dầu nhờn,… và nguyên liệu để tổng hợp các chất hữu cơ khác nhau.
- Trong công nghiệp, alkane được khai thác, chế biến từ khí thiên nhiên, khí đồng hành, dầu mỏ.
- Ô nhiễm không khí do khói thải từ các phương tiện giao thông góp phần làm Trái Đất nóng lên và gây ra sự biến đổi khí hậu toàn cầu.
- Tăng cường tham gia vận tải công cộng, giảm sự phụ thuộc nhiên liệu hóa thạch, bảo vệ rừng,… là những cách hạn chế sự ô nhiệm không khí.
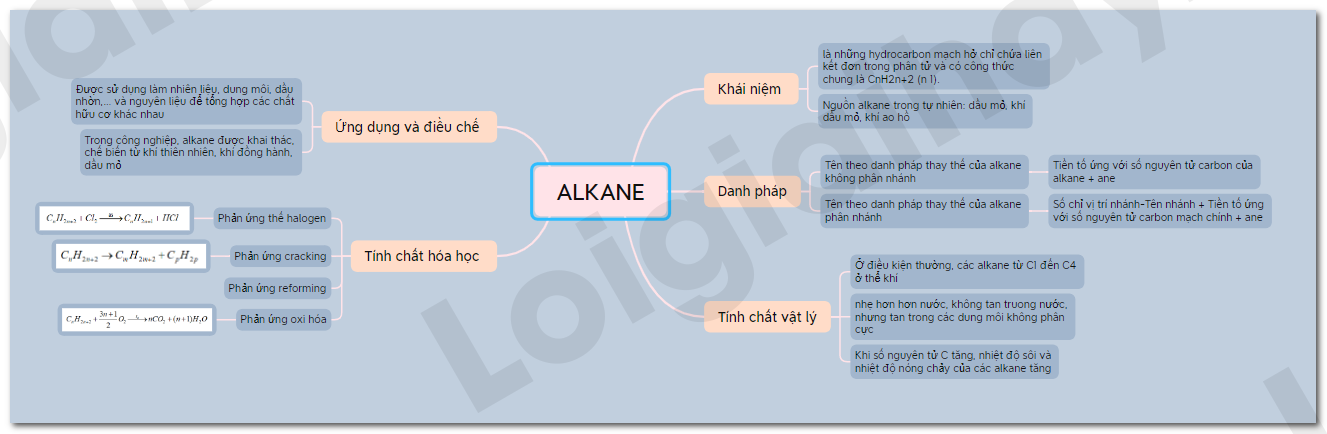
Sơ đồ tư duy Alkane
Xem thêm các bài giải SGK Hóa lớp 11 Chân trời sáng tạo hay, chi tiết khác: