Với giải Luyện tập trang 32 Hóa học lớp 11 Chân trời sáng tạo chi tiết trong Bài 5: Một số hợp chất với oxygen của nitrogen giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 11. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 11 Bài 5: Một số hợp chất với oxygen của nitrogen
Luyện tập trang 32 Hóa học 11: Viết phương trình hoá học của các phản ứng khi cho dung dịch HNO3 tác dụng với CuO, Ca(OH)2, CaCO3. Các phản ứng này có phải phản ứng oxi hoá – khử không? Giải thích.
Lời giải:
Các phương trình hoá học:
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Ca(OH)2 → Ca(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + CO2↑ + H2O.
Các phản ứng này không phải là phản ứng oxi hoá – khử; do không có sự thay đổi số oxi hoá của các nguyên tố trước và sau phản ứng.
Lý thuyết Nitric acid
a) Cấu tạo phân tử, tính chất vật lý
- Liên kết hoá học giữa các nguyên tử trong phân tử HNO3 là liên kết cộng hóa trị và liên kết cho nhận.
- Số oxi hóa của N trong HNO3 là +5. Đây là số oxi hóa cao nhất của N, do đó trong các phản ứng oxi hóa – khử, HNO3 là chất oxi hóa.
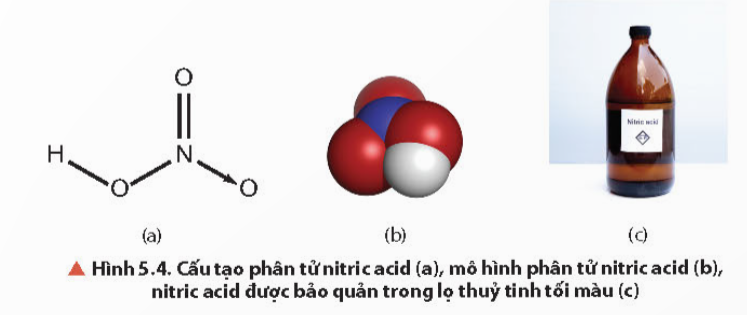
- Nitric acid tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm, có khối lượng riêng là 1,53 g/cm3, sôi ở 86˚C.
- Nitric acid tan trong nước theo bất kỳ tỉ lệ nào. Nitric acid thương mại thường có nồng độ 68%.
- Nitric acid tinh khiết kém bền, bị phân hủy ngay ở điều kiện thường khi có ánh sáng.
b) Tính chất hóa học và ứng dụng
- Nitric acid là một acid mạnh:
+ Làm quỳ tím hóa đỏ
+ Tác dụng với basic oxide
+ Tác dụng với base
+ Tác dụng với muối của acid yếu hơn -> muối nitrate
- Nitric acid là một trong ba acid chính của ngành công nghiệp hóa chất hiện đại và có tính ăn mòn kim loại.
- Nitric acid là một acid có tính oxi hóa mạnh, oxi hóa được hầu hết các kim loại trừ vàng (Au), platium (Pt),…(một số kim loại như Al, Fe, Cr,… bị thụ động hóa trong dung dịch HNO3 đặc, nguội)
- Nitric acid có nhiều ứng dụng quan trọng trong đời sống và sản xuất: sản xuất thuốc nổ trinitrotoluene, sản xuất nitrobenzene, nước cường toan, sản xuất phân bón,…

Xem thêm lời giải bài tập Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Câu hỏi thảo luận 2 trang 31 Hóa học 11: Quan sát Hình 5.2, mô tả quá trình hình thành mưa acid.....
Câu hỏi thảo luận 4 trang 31 Hóa học 11: Quan sát Hình 5.3, hãy nêu một số tác hại của mưa acid....
Câu hỏi thảo luận 6 trang 32 Hóa học 11: Tại sao phải bảo quản nitric acid trong các lọ tối màu?...
Câu hỏi thảo luận 8 trang 33 Hóa học 11: Hãy cho biết dấu hiệu nhận biết hiện tượng phú dưỡng....
Câu hỏi thảo luận 9 trang 33 Hóa học 11: Hãy nêu một số phương pháp hạn chế hiện tượng phú dưỡng....
Xem thêm các bài giải SGK Hóa lớp 11 Chân trời sáng tạo hay, chi tiết khác: