Với giải Câu hỏi thảo luận 6 trang 7 Hóa học lớp 11 Chân trời sáng tạo chi tiết trong Bài 1: Khái niệm về cân bằng hóa học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 11. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 11 Bài 1: Khái niệm về cân bằng hóa học
Câu hỏi thảo luận 6 trang 7 Hóa học 11: Viết các biểu thức tính tốc độ phản ứng thuận và tốc độ phản ứng nghịch của phản ứng thuận nghịch sau, cho biết phản ứng thuận và phản ứng nghịch đều là phản ứng đơn giản:
aA + bB ⇌ cC + dD
Lập tỉ lệ giữa hằng số tốc độ phản ứng thuận và hằng số tốc độ phản ứng nghịch ở trạng thái cân bằng.
Lời giải:
Tốc độ phản ứng thuận:
Tốc độ phản ứng nghịch:
Ở trạng thái cân bằng: vt = vn hay
Lý thuyết Hằng số cân bằng của phản ứng thuận nghịch
Tìm hiểu hằng số cân bằng của phản ứng thuận nghịch
- Nếu phản ứng thuận nghịch ở dạng:
![]()
- Khi ở trạng thái cân bằng ta có:
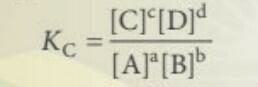
+ [A], [B], [C], [D] là nồng độ mol các chất ở trạng thái cân bằng
+ a, b, c, d hệ số tỉ lượng
+ Hằng số cân bằng Kc phụ thuộc vào nhiệt độ
Xem thêm lời giải bài tập Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Luyện tập trang 5 Hóa học 11: Viết phương trình hoá học của một số phản ứng một chiều mà em biết....
Luyện tập trang 6 Hóa học 11: Trên thực tế có các phản ứng sau:...
Luyện tập trang 7 Hóa học 11: Cho hệ cân bằng nhau:...
Câu hỏi thảo luận 8 trang 8 Hóa học 11: Nhận xét hiện tượng xảy ra trong Thí nghiệm 2....
Luyện tập trang 9 Hóa học 11: Phản ứng tổng hợp ammonia:...
Bài 3 trang 11 Hóa học 11: Viết biểu thức tính Kc cho các phản ứng sau:...
Bài 4 trang 11 Hóa học 11: Xét các hệ cân bằng sau trong một bình kín:...
Bài 5 trang 11 Hóa học 11: Cho phản ứng sau:..
Xem thêm các bài giải SGK Hóa lớp 11 Chân trời sáng tạo hay, chi tiết khác: