Lời giải bài tập Hóa học lớp 11 Bài 13: Hydrocarbon không no sách Cánh diều hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 11 Bài 13 từ đó học tốt môn Hóa 11.
Giải bài tập Hóa học lớp 11 Bài 13: Hydrocarbon không no
Lời giải:
- Hydrocarbon no: ethane (CH3 – CH3).
- Hydrocarbon không no: ethane (CH2 = CH2) và ethyne (CH ≡ CH).
I. Khái niệm, đồng phân và danh pháp
Câu hỏi 1 trang 82 Hóa học 11: Cho công thức cấu tạo của các chất dưới đây:
a) Viết công thức phân tử của các chất trên.
b) Cho biết trong các chất trên, chất nào là hydrocarbon không no, chất nào là alkene, chất nào là alkyne.
Lời giải:
a) Công thức phân tử các chất:
(1) C5H10;
(2) C5H8;
(3) C5H10;
(4) C5H8.
b) Chất là hydrocarbon không no: (2); (3); (4).
Chất là alkene: (3).
Chất là alkyne: (4).
Lời giải:
Dạng hình học của phân tử ethene: hai nguyên tử C và 4 nguyên tử H đều nằm cùng trên một mặt phẳng (gọi là mặt phẳng phân tử), các góc hầu như bằng nhau và gần bằng 120o.
Dạng hình học của phân tử ethyne: C mang liên kết ba và 2 nguyên tử H liên kết trực tiếp với chúng nằm trên cùng một đường thẳng.
Lời giải:
Công thức cấu tạo của các alkene có công thức phân tử C4H8:
(1) CH2 = CH – CH2 – CH3.
(2) CH3 – CH = CH – CH3.
(3)
- Các chất là đồng phân mạch carbon: (1) và (3); (2) và (3).
- Các chất là đồng phân vị trí liên kết đôi: (1) và (2).
Lời giải:
a)
b)
c) Đồng phân cis –
Đồng phân trans –
d)
Luyện tập 2 trang 83 Hóa học 11: Gọi tên các chất có công thức cấu tạo sau:
Lời giải:
Tên gọi các chất lần lượt là:
a) 2 – methylbut – 1 – ene.
b) pent – 2 – yne.
c) but – 1 – yne.
II. Tính chất vật lí
Lời giải:
Dựa vào khối lượng riêng và độ tan của các chất, xác định được như sau:
- Khi cho hex – 1 – ene vào ống nghiệm chứa nước xảy ra sự phân lớp, trong đó hex – 1 – ene ở lớp trên và nước ở lớp dưới do hex – 1 – ene không tan trong nước và nhẹ hơn nước.
- Khi cho hex – 1 – ene vào ống nghiệm chứa chloroform không có sự phân lớp do hex – 1 – ene tan trong chloroform.
III. Tính chất hoá học
Lời giải:
Liên kết đôi C = C gồm 1 liên kết σ và 1 liên kết π.
Năng lượng liên kết của liên kết C – C là khoảng 368 kJ mol-1 (liên kết σ).
Vậy năng lượng liên kết của liên kết π vào khoảng 636 – 368 = 268 kJ mol-1.
Vậy liên kết π dễ bị bẻ gãy hơn khi phân tử tham gia phản ứng.
Lời giải:
Các alkene, alkyne mà khi hydrogen hoá tạo thành butane là:
CH2 = CH – CH2 – CH3: but – 1 – ene.
CH3 – CH = CH – CH3: but – 2 – ene.
CH ≡ C – CH2 – CH3: but – 1 – yne.
CH3 – C ≡ C – CH3: but – 2 – yne.
a) 2 – methylbut – 2 – ene phản ứng với HBr.
b) 2 – methylbut – 1 – ene phản ứng với nước (xúc tác H2SO4).
Lời giải:
a)
b)
Câu hỏi 6 trang 87 Hóa học 11: Viết phương trình hoá học của phản ứng trùng hợp propene.
Lời giải:
Thí nghiệm 1 trang 89 Hóa học 11: Điều chế và thử tính chất của ethylene
Chuẩn bị: Ethanol, dung dịch sulfuric acid đặc, nước bromine, dung dịch KMnO4 1%, dung dịch NaOH đặc; ống nghiệm, giá thí nghiệm, ống dẫn khí hình chữ L, ống dẫn khí hình chữ Z có một đầu được vuốt nhọn, đèn cồn, bông.
Tiến hành: Cho 2 mL ethanol vào ống nghiệm khô, thêm dần từng giọt 4 mL dung dịch sulfuric acid đặc (cho chảy dọc theo thành ống nghiệm), lắc đều. Cho vào ống nghiệm một ít cát hoặc 1 – 2 mảnh sứ xốp. Kẹp ống nghiệm lên giá và lắp với ống dẫn khí hình chữ L qua phần ống nối có mẩu bông tẩm dung dịch NaOH đặc. Đun nóng ống nghiệm và sục ống dẫn khí vào ống nghiệm có chứa khoảng 1 mL nước bromine. Khi nước bromine bị mất màu thì thay ống nghiệm bằng ống nghiệm khác có chứa 1 mL dung dịch KMnO4 1%. Khi màu tím biến mất thì thay ống dẫn khí hình chữ L bằng ống dẫn khí hình chữ Z (đầu được vuốt nhọn hướng lên phía trên) và đốt khí thoát ra ở đầu ống dẫn khí.
Yêu cầu: Quan sát, viết phương trình hoá học và giải thích hiện tượng xảy ra.
Chú ý an toàn: Ethanol dễ bắt lửa và cháy; sulfuric acid và dung dịch NaOH đặc phá huỷ vải, da,... khi tiếp xúc.
Lời giải:
Hiện tượng: có khí sinh ra, khí này làm mất màu dung dịch bromine, làm mất màu thuốc tím. Đốt khí thoát ra ở đầu ống dẫn khí, thấy khí cháy và toả nhiều nhiệt.
Phương trình hoá học giải thích hiện tượng:
C2H5OH CH2 = CH2 + H2O
CH2 = CH2 + Br2 → CH2Br – CH2Br
3CH2 = CH2 + 2KMnO4 + 4H2O → 3HO – CH2 – CH2 – OH + 2MnO2 + 2KOH
C2H4 + 3O2 2CO2 + 2H2O.
Đun ethanol với sulfuric acid đặc sinh ra khí ethylene; dẫn tiếp khí qua ống nghiệm đựng Br2 (hoặc thuốc tím) thấy dung dịch Br2 (hoặc dung dịch KMnO4) nhạt dần đến mất màu do liên kết pi ở liên kết đôi của ethylene kém bền vững.
Thí nghiệm 2 trang 89 Hóa học 11: Điều chế và thử tính chất của acetylene
Chuẩn bị: Đất đèn (thành phần chính là calcium carbide), nước bromine, dung dịch KMnO4 1%; ống nghiệm, giá thí nghiệm, ống dẫn khí hình chữ L, ống dẫn khí hình chữ Z có một đầu được vuốt nhọn.
Tiến hành: Cho 2 mL nước vào ống nghiệm, thêm vào đó vài viên đất đèn bằng hạt ngô, rồi đậy nhanh ống nghiệm bằng nút có gắn ống dẫn khí hình chữ L. Sục ống dẫn khí vào ống nghiệm có chứa khoảng 1 mL nước bromine, khi nước bromine bị mất màu thì thay ống nghiệm bằng ống nghiệm khác có chứa 1 mL dung dịch KMnO4 1%. Khi màu tím biến mất thì thay ống dẫn khí hình chữ L bằng ống dẫn khí hình chữ Z (đầu được vuốt nhọn hướng lên phía trên) và đốt khí thoát ra ở đầu ống dẫn khí.
Yêu cầu: Quan sát, viết phương trình hoá học và giải thích hiện tượng xảy ra.
Lời giải:
Hiện tượng: Đất đèn (thành phần chính CaC2) tác dụng với nước sinh ra khí acetylene (C2H2). Dẫn acetylene vào các ống nghiệm chứa dung dịch KMnO4 và nước Br2 thấy các dung dịch này nhạt dần đến mất màu do liên kết pi ở acetylene kém bền vững.
Khi đốt acetylene cháy, toả nhiều nhiệt.
Phương trình hoá học minh hoạ:
CaC2 + 2H2O → Ca(OH)2 + C2H2
CH ≡ CH + 2Br2 → CHBr2 – CHBr2
3CH ≡ CH + 8KMnO4 → 3KOOC – COOK + 8MnO2 + 2KOH + 2H2O
Lời giải:
Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
Sử dụng dung dịch AgNO3/ NH3 (dung dịch silver nitrate trong ammonia) làm thuốc thử.
Nếu xuất hiện kết tủa vàng → hex – 1 – yne. Phương trình hoá học:
CH3[CH2]3C ≡ CH + Ag(NH3)2OH → CH3[CH2]3C ≡ CAg + 2NH3 + H2O.
Không có hiện tượng gì xuất hiện → hex – 2 – yne.
Lời giải:
- Phản ứng cháy hoàn toàn của alkane:
Trong phản ứng đốt cháy hoàn toàn alkane:
- Phản ứng cháy hoàn toàn của alkene:
Trong phản ứng đốt cháy hoàn toàn alkene:
- Phản ứng đốt cháy hoàn toàn alkyne:
Trong phản ứng đốt cháy hoàn toàn alkene:
a) Viết phương trình hoá học của phản ứng xảy ra.
b) Vì sao cần dẫn khí từ ống nghiệm điều chế ethylene qua ống có chứa mẩu bông tẩm dung dịch NaOH đặc?
Lời giải:
a) Phương trình hoá học của phản ứng xảy ra:
C2H5OH CH2 = CH2 + H2O
b) Khí ethylene sinh ra có thể có lẫn các tạp chất như CO2, SO2… bông tẩm dung dịch NaOH đặc có tác dụng loại bỏ các tạp chất này.
Phương trình hoá học minh hoạ:
CO2 + 2NaOH → Na2CO3 + H2O
SO2 + 2NaOH → Na2SO3 + H2O.
IV. Ứng dụng và điều chế alkene, alkyne
Lời giải:
Rau khi bày bán trong các siêu thị thường được chứa trong các túi nylon có lỗ để giảm bớt tích tụ khí ethylene trong túi rau, giúp rau tươi lâu hơn.
Bài tập (trang 91)
Bài 1 trang 91 Hóa học 11: Viết công thức cấu tạo của các chất có tên dưới đây:
a) pent – 2 – ene
b) 2 – methylbut – 2 – ene
c) 3 – methylbut – 1 – yne
d) 2 – methylpropene
Lời giải:
a) pent – 2 – ene: CH3 – CH = CH – CH2 – CH3.
b) 2 – methylbut – 2 – ene:
c) 3 – methylbut – 1 – yne:
d) 2 – methylpropene:
a) CH ≡ CH + 2H2
b) CH3 – C ≡ CH + 2HBr →
c) CH ≡ CH + 2Br2 →
Lời giải:
a) CH ≡ CH + 2H2 CH3 – CH3.
b) CH3 – C ≡ CH + 2HBr → CH3 – CBr2 – CH3.
c) CH ≡ CH + 2Br2 → CHBr2 – CHBr2.
Lời giải:
Dẫn lần lượt từng khí qua ống nghiệm chứa dung dịch AgNO3/ NH3 (dung dịch silver nitrate trong ammonia):
- Nếu có kết tủa vàng xuất hiện → khí acetylene.
CH ≡ CH + 2[Ag(NH3)2]OH → CAg ≡ CAg + 4NH3 + 2H2O.
- Không có hiện tượng xuất hiện là ethane, ethylene (nhóm I).
Dẫn lần lượt từng khí ở nhóm I vào ống nghiệm chứa dung dịch bromine:
- Nếu dung dịch bromine nhạt dần đến mất màu → ethylene.
CH2 = CH2 + Br2 → CH2Br – CH2Br.
- Không có hiện tượng xuất hiện → ethane.
Bài 4 trang 91 Hóa học 11: Cho các đoạn mạch polymer như ở dưới đây:
Viết phương trình hoá học tổng hợp các polymer ấy từ các alkene tương ứng.
Lời giải:
Lời giải:
- Có thể sử dụng methyl alcohol, cyclohexane làm dung môi cho phản ứng trùng hợp ethylene do các dung môi này hoà tan ethylene nhưng không hoà tan PE.
- Không sử dụng nước làm dung môi cho phản ứng trùng hợp ethylene do nước không hoà tan ethylene.
- Không sử dụng hex – 1 – ene làm dung môi cho phản ứng trùng hợp do có thể tạo ra polime khác PE.
Lý thuyết Hydrocarbon không no
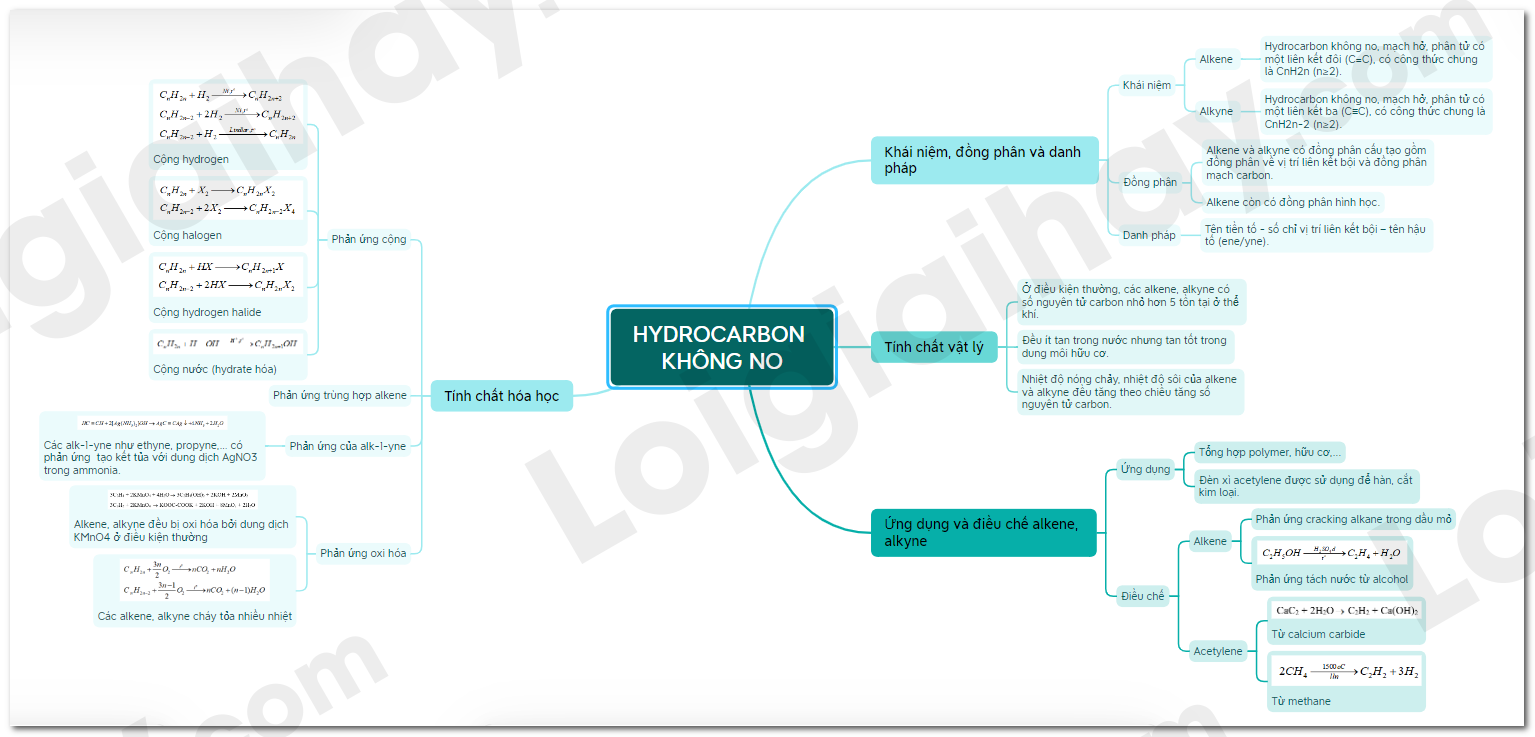
I. Khái niệm, đồng phân và danh pháp
1. Khái niệm
-Alkene là hydrocarbon không no, mạch hở, phân tử có một liên kết đôi (C=C), có công thức chung là CnH2n (n≥2).
-Alkyne là hydrocarbon không no, mạch hở, phân tử có một liên kết ba (C≡C), có công thức chung là CnH2n-2 (n≥2).
2. Đồng phân
-Alkene và alkyne có đồng phân cấu tạo gồm đồng phân về vị trí liên kết bội và đồng phân mạch carbon.
-Alkene còn có đồng phân hình học.
3. Danh pháp
-Tên của alkene và alkyne mạch không phân nhánh:
Tên tiền tố - số chỉ vị trí liên kết bội – tên hậu tố (ene/yne).
-Tên của alkene, alkyne có mạch chính được gọi như sau:
Số chỉ vị trí của mạch nhánh – tên mạch nhánh+tên tiền tố (mạch chính) – số chỉ vị trí liên kết bội – tên hậu tố.
II. Tính chất vật lý
-Ở điều kiện thường, các alkene, alkyne có số nguyên tử carbon nhỏ hơn 5 tồn tại ở thể khí.
-Đều ít tan trong nước nhưng tan tốt trong dung môi hữu cơ.
-Nhiệt độ nóng chảy, nhiệt độ sôi của alkene và alkyne đều tăng theo chiều tăng số nguyên tử carbon.
III. Tính chất hóa học
1. Phản ứng cộng
- Cộng hydrogen
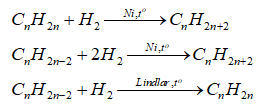
-Cộng halogen
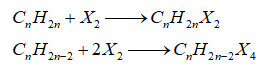
-Cộng hydrogen halide
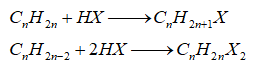
-Cộng nước (hydrate hóa)
![]()
-Quy tắc Markovnikov: Nguyên tử hydrogen ưu tiên cộng vào nguyên tử carbon chưa no có nhiều hydrogen hơn, còn nguyên tử X ưu tiên cộng vào nguyên tử carbon chưa no có ít hydrogen hơn.
2. Phản ứng trùng hợp alkene
- Dưới áp suất, xúc tác và nhiệt độ thích hợp, các alkene tham gia phản ứng cộng liên tiếp các phân tử với nhau tạo phân tử polymer.
3. Phản ứng của alk-1-yne với dung dịch silver nitrate trong ammonia
![]()
-Các alk-1-yne như ethyne, propyne,… có phản ứng tạo kết tủa với dung dịch AgNO3 trong ammonia.
4. Phản ứng oxi hóa
a) Phản ứng với dung dịch potassium permanganate
- Alkene, alkyne đều bị oxi hóa bởi dung dịch KMnO4 ở điều kiện thường
3C2H4 + 2KMnO4 + 4H2O 3C2H4(OH)2 + 2KOH + 2MnO2
3C2H2 + 2KMnO4 KOOC-COOK + 2KOH + 8MnO2 + 2H2O
b) Phản ứng cháy
- Các alkene, alkyne cháy tỏa nhiều nhiệt:
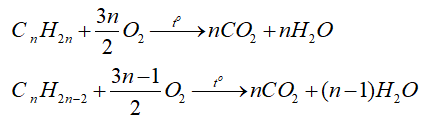
IV. Ứng dụng và điều chế alkene, alkyne
1. Ứng dụng
-Alkene là nguyên liệu để tổng hợp một số polymer như PE, PP,…
-Alkyne được dùng làm nguyên liệu cho tổng hợp hữu cơ.
-Ethylene và acetylene được dùng để làm chín trái cây, điều khiển quá trình sinh mủ của cây cao su.
-Đèn xì acetylene được sử dụng để hàn, cắt kim loại.
2. Điều chế
-Trong công nghiệp, alkene thường được điều chế từ phản ứng cracking alkane trong dầu mỏ.
-Alkene còn được điều chế bằng phản ứng tách nước từ alcohol:
![]()
-Acetylene được điều chế bằng cách cho calcium carbide tác dụng với nước:
CaC2 + 2H2O C2H2 + Ca(OH)2
-Acetylene trong công nghiệp được sản xuất chủ yếu từ methane:
![]()
Sơ đồ tư duy Hydrocarbon không no
Xem thêm các bài giải SGK Hóa học lớp 11 Cánh diều hay, chi tiết khác: