Với giải Câu hỏi 8 trang 13 Hóa học lớp 11 Kết nối tri thức chi tiết trong Bài 1: Khái niệm về cân bằng hoá học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 11. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 11 Bài 1: Khái niệm về cân bằng hoá học
Câu hỏi 8 trang 13 Hóa học 11: Cho các cân bằng sau:
CaCO3(s) ⇌ CaO(s) + CO2(g) 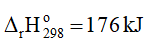
2SO2(g) + O2(g) ⇌ 2SO3(g) 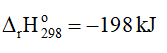
Nếu tăng nhiệt độ, các cân bằng trên chuyển dịch theo chiều nào? Giải thích.
Lời giải:
1. Cân bằng: CaCO3(s) ⇌ CaO(s) + CO2(g)
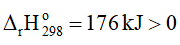
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều thuận, tức là chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ.
2. Cân bằng: 2SO2(g) + O2(g) ⇌ 2SO3(g)
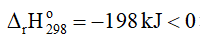
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch, tức là chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ.
Lý thuyết Các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học
a. Ảnh hưởng của nhiệt độ
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ, tức là chiều phân ứng thu nhiệt ( Ar, Ho298> 0), nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ và ngược lại
b. Ảnh hưởng của nồng độ
Khi tăng nồng độ một chất trong phản ứng thì cân bằng hoá học bị phá vỡ và chuyển dịch theo chiều làm giảm nồng độ của chất đó và ngược lại.
c. Nguyên lý chuyển dịch cân bằng Le Chatelier
Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động bên ngoài làm thay đổi nồng độ, nhiệt độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
Nguyên lí chuyển dịch cân bằng Le Chatelier có ý nghĩa rất lớn khi được vận dụng vào kĩ thuật công nghiệp hoá học. Người ta có thể thay đổi các điều kiện để chuyển dịch cân bằng theo chiều mong muốn, làm tăng hiệu suất của phản ứng
Video bài giảng Hóa học 11 Bài 1: Khái niệm về cân bằng hoá học - Kết nối tri thức
Xem thêm lời giải bài tập Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Câu hỏi 3 trang 8 Hóa học 11: Nhận xét nào sau đây không đúng?....
Hoạt động trang 8 Hóa học 11: Xét phản ứng thuận nghịch: H2(g) + I2(g) ⇌ 2HI(g)....
Câu hỏi 4 trang 9 Hóa học 11: Cho phản ứng: 2HI(g) ⇌ H2(g) + I2(g)...
Câu hỏi 5 trang 9 Hóa học 11: Cho các nhận xét sau:...
Hoạt động trang 9 Hóa học 11: Xét phản ứng thuận nghịch: H2(g) + I2(g) ⇌ 2HI(g)...
Câu hỏi 6 trang 10 Hóa học 11: Viết biểu thức hằng số cân bằng cho các phản ứng sau:..
Câu hỏi 7 trang 10 Hóa học 11: Ammonia (NH3) được điều chế bằng phản ứng: N2(g) + 3H2(g) ⇌ 2NH3(g).....
Thí nghiệm 1 trang 10 Hóa học 11: Ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng:....
Câu hỏi 8 trang 13 Hóa học 11: Cho các cân bằng sau:...
Câu hỏi 10 trang 14 Hóa học 11: Cho các cân bằng sau:....
Câu hỏi 11 trang 14 Hóa học 11: Trong công nghiệp, khí hydrogen được điều chế như sau:....
Xem thêm các bài giải SGK Hóa lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 1: Khái niệm về cân bằng hoá học