Với giải Hoạt động trang 9 Hóa học lớp 11 Kết nối tri thức chi tiết trong Bài 1: Khái niệm về cân bằng hoá học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 11. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 11 Bài 1: Khái niệm về cân bằng hoá học
Hoạt động trang 9 Hóa học 11: Xét phản ứng thuận nghịch: H2(g) + I2(g) ⇌ 2HI(g)
Thực hiện phản ứng trên ở trong bình kín, ở nhiệt độ 445 oC với các nồng độ ban đầu khác nhau. Số liệu về nồng độ các chất ở thời điểm ban đầu và trạng thái cân bằng trong các thí nghiệm được trình bày trong Bảng 1.2.
Bảng 1.2. Nồng độ các chất của phản ứng H2(g) + I2(g) ⇌ 2HI(g) ở thời điểm ban đầu và ở trạng thái cân bằng.
Tính giá trị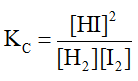
Lời giải:
Giá trị hằng số cân bằng ở mỗi thí nghiệm:
- Thí nghiệm 1:
- Thí nghiệm 2: 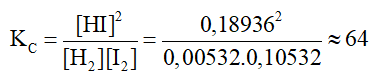
- Thí nghiệm 3: 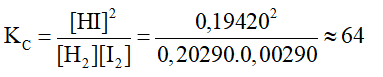
Nhận xét: Hằng số cân bằng KC của một phản ứng thuận nghịch chỉ phụ thuộc vào nhiệt độ và bản chất của phản ứng.
Lý thuyết Cân bằng hóa học
a. Trạng thái cân bằng
Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Cân bằng hoá học là một cân bằng động, các chất tham gia phản ứng liên tục phản ứng với nhau để tạo thành sản phẩm và các chất sản phẩm cũng liên tục phản ứng với nhau để tạo thành các chất đầu nhưng với tốc độ bằng nhau nên ở trạng thái cần bằng, nồng độ các chất không thay đổi.
b. Hằng số cân bằng
* Biểu thức của hằng số cân bằng
Xét phản ứng thuận nghịch tổng quát aA + bB ⇌ cC + dD:
Ở trạng thái cân bằng, hằng số cân bằng (Kc) của phản ứng được xác định theo biểu thức:
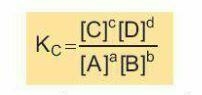
Trong đó: [A], [B], [C], [D] là nồng độ mol của các chất A, B, C, D ở trạng thái cân bằng. a, b, c, d là hệ số tỉ lượng của các chất trong phương trình hoá học của phản ứng. Thực nghiệm cho thấy hằng số cân bằng Kc của một phản ứng thuận nghịch chỉ phụ thuộc nhiệt độ và bản chất của phản ứng. Đối với các phản ứng có chất rắn tham gia, không biểu diễn nồng độ của chất rắn trong biểu thức hằng số cân bằng.
* Ý nghĩa của hằng số cân bằng
Hằng số cân bằng Kc phụ thuộc vào bản chất của phản ứng và nhiệt độ. Từ biểu thức xác định hằng số cân bằng Kc, ta có thể thấy rằng: Kc càng lớn thì phản ứng thuận càng chiếm ưu thế hơn và ngược lại. Kc càng nhỏ thi phản ứng nghịch càng chiếm ưu thế hơn.
Video bài giảng Hóa học 11 Bài 1: Khái niệm về cân bằng hoá học - Kết nối tri thức
Xem thêm lời giải bài tập Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Câu hỏi 3 trang 8 Hóa học 11: Nhận xét nào sau đây không đúng?....
Hoạt động trang 8 Hóa học 11: Xét phản ứng thuận nghịch: H2(g) + I2(g) ⇌ 2HI(g)....
Câu hỏi 4 trang 9 Hóa học 11: Cho phản ứng: 2HI(g) ⇌ H2(g) + I2(g)...
Câu hỏi 5 trang 9 Hóa học 11: Cho các nhận xét sau:...
Hoạt động trang 9 Hóa học 11: Xét phản ứng thuận nghịch: H2(g) + I2(g) ⇌ 2HI(g)...
Câu hỏi 6 trang 10 Hóa học 11: Viết biểu thức hằng số cân bằng cho các phản ứng sau:..
Câu hỏi 7 trang 10 Hóa học 11: Ammonia (NH3) được điều chế bằng phản ứng: N2(g) + 3H2(g) ⇌ 2NH3(g).....
Thí nghiệm 1 trang 10 Hóa học 11: Ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng:....
Câu hỏi 8 trang 13 Hóa học 11: Cho các cân bằng sau:...
Câu hỏi 10 trang 14 Hóa học 11: Cho các cân bằng sau:....
Câu hỏi 11 trang 14 Hóa học 11: Trong công nghiệp, khí hydrogen được điều chế như sau:....
Xem thêm các bài giải SGK Hóa lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 1: Khái niệm về cân bằng hoá học