Với giải sách bài tập Hoá học 10 Ôn tập chương 5 sách Chân trời sáng tạo hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hoá học 10. Mời các bạn đón xem:
Giải SBT Hoá học lớp 10 Ôn tập chương 5
OT5.1 trang 60 SBT Hóa học 10. Tìm hiểu và giải thích 2 quá trình sau:
a. Tại sao khi xoa cồn vào da, ta cảm thấy lạnh?
b. Phản ứng phân hủy Fe(OH)3 (s) phải cung cấp nhiệt độ liên tục.
Lời giải:
a) Khi xoa cồn vào da, ta cảm thấy lạnh do cồn có nhiệt độ bay hơi thấp, khi bay hơi cơ thể bị tản nhiệt, làm ta cảm thấy mát ở vùng da đó.
b) Phản ứng phân huỷ Fe(OH)3 là phản ứng thu nhiệt nên cần phải cung cấp nhiệt độ liên tục).
Ở cả 2 quá trình trên đều cần cung cấp năng lượng.
OT5.2 trang 60 SBT Hóa học 10. Cho phương trình nhiệt hóa học của phản ứng sau:
Kim cương hay graphite là dạng bền hơn của carbon?
Lời giải:
Phương trình nhiệt hoá học của phản ứng:
C (kim cương) ![]() C (graphite) = -1,9 kJ
C (graphite) = -1,9 kJ
Graphite là dạng bền hơn của carbon (do < 0)
OT5.3 trang 60 SBT Hóa học 10. Cho hai phương trình nhiệt hóa học sau:
So sánh nhiệt giữa hai phản ứng (1) và (2). Phản ứng nào xảy ra thuận lợi hơn?
Lời giải:
= -283,00 kJ (1)
= -546,00 kJ (2)
So sánh nhiệt giữa hai phản ứng. Phản ứng (2) xảy ra thuận lợi hơn.
OT5.4 trang 60 SBT Hóa học 10. Cho hai phương trình nhiệt hóa học sau:
Khi đốt cháy cùng 1 mol CO và C2H5OH thì phản ứng nào tỏa ra lượng nhiệt lớn hơn?
Lời giải:
= -283,00 kJ (1)
= -1366,89 kJ (3)
So sánh nhiệt giữa hai phản ứng khi đốt cháy cùng 1 mol CO và thì phản ứng (3) toả ra lượng nhiệt lớn hơn.
OT5.5 trang 60 SBT Hóa học 10. Cho phương trình nhiệt hóa học sau:
Vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng.
Lời giải:
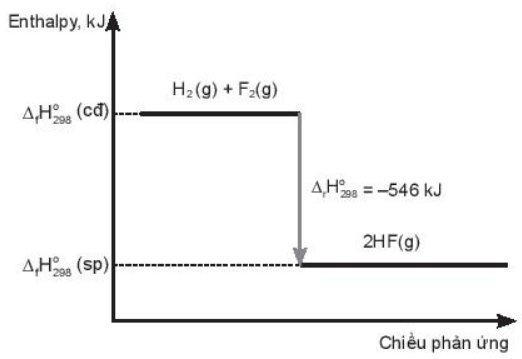
OT5.6 trang 60 SBT Hóa học 10. Cho các phương trình nhiệt hóa học sau:
Xác định biến thiên enthalpy của 2 phản ứng sau:
Lời giải:
Biến thiên enthalpy của 2 phản ứng:
= -285,84 kJ
= -25,9 kJ
OT5.7 trang 61 SBT Hóa học 10. Mỗi quá trình dưới đây là tự diễn ra hay không?
a) Cho CaC2 vào nước, khí C2H2 thoát ra.
b) Khí CO khử FeO ở nhiệt độ phòng.
c) Các phân tử nước được chuyển thành khí hydrogen và oxygen.
Với quá trình không tự diễn ra, dự đoán giá trị của nhiệt phản ứng.
Lời giải:
Quá trình (a), phản ứng tự diễn ra.
Quá trình (b), phản ứng không tự diễn ra. Giá trị > 0.
Quá trình (c), phản ứng không tự diễn ra. Giá trị > 0.
Lời giải:
Phản ứng trên toả nhiệt do . Dùng que đóm còn tàn đỏ để chứng minh khí sinh ra là oxygen (hiện tượng: que đóm bùng cháy).
Ứng dụng của thí nghiệm trên trong thực tiễn:
Hydrogenperoxide khử trùng, sát khuẩn nước, xử lí nước trong hồ. H2O2 nồng độ thấp hơn 3%, được dùng đề sát trùng vết thương, loại bỏ các mô chết. Sử dụng trong nuôi trồng thuỷ sinh.
OT5.9 trang 61 SBT Hóa học 10. Cho phương trình nhiệt hóa học sau:
a. Vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng.
Lời giải:
a) Sơ đồ biểu diễn biến thiên enthalpy của phản ứng có dạng sau:
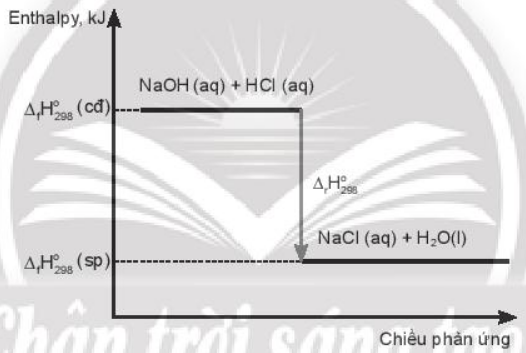
b) Lượng nhiệt toả ra khi dùng dung dịch có chứa 8 g NaOH trung hoà với lượng vừa đủ dung dịch HCl là:
nNaOH = 0,2 mol ⇒ = -57,3.0,2 = -11,46 kJ.
b. Nếu phân hủy 45,4 g trinitroglycerin, tính số mol khí và hơi tạo thành.
Lời giải:
a) Phương trình hoá học:
b)
⇒ ∑nkhí/hơi = 0,6 + 0,5 + 0,05 + 0,3 = 1,45 (mol)
c) Phân huỷ 1 mol (hay 227 g)
⇒ Phân huỷ 1 kg hay 1 000 g
OT5.11 trang 62 SBT Hóa học 10. Cho các phương trình nhiệt hóa học của phản ứng:
Lời giải:
1,2 g H2 tương đương với 0,6 mol.
Ở điều kiện chuẩn, đốt cháy hoàn toàn 1,2 g H2 lượng nhiệt toả ra:
= -171,504 kJ.
3,2 gam S tương đương với 0,1 mol.
Cho 3,2 g S phản ứng hoàn toàn với oxygen để tạo ra SO3(g) cần cung cấp lượng nhiệt là = 39,61 kJ.
Lời giải:
Silver bromide (AgBr) là chất nhạy cảm với ánh sáng dùng để tráng lên phim. Dưới tác dụng của ánh sáng, nó phân huỷ thành kim loại bạc (ở dạng bột màu đen) bám trên tấm phim và bromine (ở dạng hơi).
Phản ứng xảy ra là phản ứng thu nhiệt.
Sau khi chụp ảnh, phim được rửa bằng dung dịch (chất xử lí ảnh), hoà tan AgBr còn lại, trên phim chỉ còn lại Ag bám trên đó tạo hình ảnh âm bản cho tấm phim.
(phức sodium bis(thiosulfato)argentate(l))
Tính năng lượng tối đa khi một người bệnh được truyền 1 chai 500 mL dung dịch glucose 5%.
Lời giải:
= -2 803,0 kJ/mol
1 chai 500 mL dung dịch glucose 5% có chứa khối lượng glucose là:
Năng lượng tối đa khi một người bệnh được truyền 1 chai 500 mL dung dịch glucose 5% (D = 1,1 g/ mL) là:
a) Mục đích việc pha trộn thêm chất tạo mùi đặc trưng vào khí gas là gì?
b) Cho các phương trình nhiệt hóa học sau:
Lời giải:
a) Mục đích pha trộn thêm chất tạo mùi đặc trưng vào khí gas để giúp phát hiện khí gas khi xảy ra sự cố rò rỉ.
b) Nhiệt dung riêng của nước: 1 kcal = 4,184 kJ (nhiệt lượng cần thiết tăng 1 lít nước lên 1°C). Nhiệt lượng toả ra khi đốt cháy hoàn toàn 1 bình gas 12 kg:
+ Khối lượng propane trong bình gas: 12.0,3 = 3,6 kg.
Số mol propane == 81,8181 mol
Nhiệt lượng tỏa ra khi đốt propane trong bình gas: 81,8181. 2220 = 181 636,36 kJ.
+ Khối lượng butane trong bình gas: 12.0,7 = 8,4 kg.
Số mol butane = = 144,8275 mol
Nhiệt lượng tỏa ra khi đốt butane trong bình gas: 144,8275.2874 = 416 234,235 kJ.
Nhiệt lượng tỏa ra khi đốt cháy hoàn toàn 1 bình gas 12 kg:
181 636,36 + 416 234,235 = 597 870,595 kJ.
c) Giả sử một hộ gia đình cần 6000 kJ nhiệt mỗi ngày, số ngày sẽ sử dụng hết 1 bình gas (với hiệu suất hấp thụ nhiệt khoảng 60%) là:
ngày
Xem thêm các bài giải SBT Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học