Với giải Bài 16.12 trang 44 SBT Hóa học lớp 10 Kết nối tri thức chi tiết trong Ôn tập chương 4 giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 10. Mời các bạn đón xem:
Giải sách bài tập Hóa học lớp 10 Ôn tập chương 4
Bài 16.12 trang 44 SBT Hóa học 10: Dẫn khí SO2 vào 100 mL dung dịch KMnO4 0,02M đến khi dung dịch vừa mất màu tím.
Phản ứng xảy ra theo sơ đồ sau:
SO2 + KMnO4 + H2O → H2SO4 + K2SO4 + MnSO4
a) Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron.
b) Xác định thể tích khí SO2 đã tham gia phản ứng ở điều kiện chuẩn.
Lời giải
a) 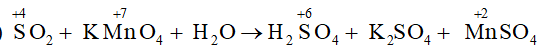
Xác định được hệ số của SO2 là 5, KMnO4 và MnSO4 là 2, sau đó cân bằng nguyên tố S và H tìm được hệ số của H2SO4 là 2, của H2O là 2.
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + K2SO4 + 2MnSO4
b) Theo phương trình hóa học ta có:
= 24,79.0,005 = 0,12395 L = 123,95 (mL)
Xem thêm các bài giải SBT Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 16.1 trang 42 SBT Hóa học 10: Trong quá trình oxi hóa – khử, chất nhường electron được gọi là
Bài 16.2 trang 42 SBT Hóa học 10: Iron có số oxi hóa +2 trong hợp chất nào sau đây?
Bài 16.3 trang 42 SBT Hóa học 10: Chromium(VI) oxide, CrO3, là chất rắn, màu đỏ thẫm, vừa là acidic oxide, vừa là chất oxi hóa mạnh. Số oxi hóa của chlomium trong oxide trên là
Bài 16.4 trang 43 SBT Hóa học 10: Phản ứng kèm theo sự cho và nhận electron được gọi là phản ứng
Bài 16.5 trang 43 SBT Hóa học 10: Xét phản ứng điều chế H2 trong phòng thí nghiệm:
Bài 16.6 trang 43 SBT Hóa học 10: Cho các hợp chất sau: NH3, NH4Cl, HNO3, NO2.
Bài 16.7 trang 43 SBT Hóa học 10: Nguyên tử sulfur chỉ thể hiện tính khử trong hợp chất nào sau đây?
Bài 16.8 trang 43 SBT Hóa học 10: Nguyên tử carbon vừa có khả năng thể hiện tính oxi hóa, vừa có khả năng thể hiện tính khử trong chất nào sau đây?
Bài 16.9 trang 43 SBT Hóa học 10: Hợp chất nào sau đây chứa hai loại nguyên tử iron với số oxi hóa +2 và +3?
Bài 16.10 trang 43 SBT Hóa học 10: Cho các phân tử sau: H2S, SO3, CaSO4, Na2S, H2SO4.
Bài 16.13 trang 44 SBT Hóa học 10: Thực hiện các phản ứng sau:
Bài 16.14 trang 44 SBT Hóa học 10: Đốt cháy hoàn toàn 2,52 g hỗn hợp gồm Mg và Al cần vừa đủ 2,479 L hỗn hợp khí X gồm O2 và Cl2 ở điều kiện chuẩn, thu được 8,84 g chất rắn.
Xem thêm các bài giải SBT Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 15: Phản ứng oxi hóa - khử