Với giải Câu 5 trang 76 Hóa học lớp 10 Kết nối tri thức với cuộc sống chi tiết trong Bài 15: Phản ứng oxi hóa - khử giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 15: Phản ứng oxi hóa - khử
Câu 5 trang 76 Hóa học 10: Lập phương trình hóa học của các phản ứng trong quá trình sản xuất sulfuric acid theo sơ đồ mục IV.3. Trong các phản ứng đó, phản ứng nào là phản ứng oxi hóa – khử?
Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử.
Lời giải:

Lý thuyết Phản ứng oxi hóa – khử trong thực tiễn
1. Sự cháy
Phản ứng cháy là phản ứng oxi hóa – khử xảy ra ở nhiệt độ cao giữa chất cháy và chất oxi hóa. Chất cháy thường là nhiên liệu (than đá, khí thiên nhiên, xăng dầu, …), còn chất oxi hóa thường là oxygen.
Ví dụ: Phản ứng oxi hóa – khử xảy ra khi đốt cháy carbon trong than đá và butane trong khí gas:
C + O2 CO2
2C4H10 + 13O2 8CO2 + 10H2O
2. Sự han gỉ kim loại
Sau một thời gian sử dụng, nhiều thiết bị, máy móc, vật dụng bằng kim loại thường bị han gỉ, do sự oxi hóa bởi oxygen trong không khí.
Ví dụ: Trong không khí ẩm, các vật dụng bằng thép bị oxi hóa tạo gỉ sắt.
4Fe + 3O2 + xH2O 2Fe2O3.xH2O
3. Sản xuất hóa chất
Trong công nghiệp, phần lớn các phản ứng hóa học xảy ra trong các quy trình sản xuất là phản ứng oxi hóa – khử.
Ví dụ: Sulfuric acid là hóa chất quan trọng trong công nghiệp, được sản xuất chủ yếu từ sulfur hoặc quặng pyrite.
Sơ đồ phản ứng;
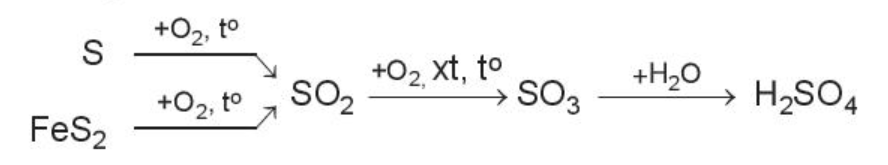
4. Chuyển hóa các chất trong tự nhiên
Trong tự nhiên cũng xảy ra rất nhiều quá trình kèm theo phản ứng oxi hóa – khử.
Ví dụ: Tia sét tạo tia lửa điện, là điều kiện cho nitrogen phản ứng với oxygen:
N2 + O2 2NO
Khí NO sinh ra nhanh chóng chuyển hóa thành NO2, sau đó tiếp tục bị oxi hóa thành HNO3:
2NO + O2 2NO2
4NO2 + O2 + 2H2O 4HNO3
Nitric acid tan vào nước mưa và chuyển hóa thành gốc nitrate () , cung cấp chất đạm cho cấy lúa. Nhờ quá trình trên, hàng năm một lượng lớn phân đạm tự nhiên được bổ sung cho đất.
5. Xác định nồng độ của một chất dựa vào phản ứng oxi hóa – khử
- Trong thực tế, dung dịch thuốc tím (KMnO4) được sử dụng phổ biến như một tác nhân oxi hóa mạnh để xác định hàm lượng các chất khử như iron(II); hydrogen peroxide, oxalic acid, …
Ví dụ: Trong quá trình bảo quản, một mẫu iron (II) sulfate bị oxi hóa một phần thành hợp chất iron (III). Hàm lượng iron (II) sulfate còn lại trong mẫu được xác định thông qua phản ứng với dung dịch thuốc tím có nồng độ đã biết:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Mở đầu trang 71 Hóa học 10: Trong lò luyện gang, xảy ra phản ứng oxi hóa – khử theo sơ đồ sau:...
Câu 1 trang 73 Hóa học 10: Xác định số oxi hóa của nguyên tử Fe và S trong các chất sau:...
Câu 3 trang 75 Hóa học 10: Xét các phản ứng hóa học xảy ra trong công nghiệp:...
Câu 4 trang 76 Hóa học 10: Nêu một số phản ứng oxi hóa – khử có lợi và có hại tron thực tế...
Xem thêm các bài giải SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 15: Phản ứng oxi hóa - khử
Bài 17: Biến thiên enthalpy trong các phản ứng hóa học