Lời giải bài tập Khoa học tự nhiên lớp 7 Bài 2: Nguyên tử sách Kết nối tri thức ngắn gọn, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi KHTN 7 Bài 2 từ đó học tốt môn Khoa học tự nhiên 7.
Giải bài tập KHTN lớp 7 Bài 2: Nguyên tử
Video giải KHTN 7 Bài 2: Nguyên tử - Kết nối tri thức
Phương pháp giải:
- Nguyên tử có cấu tạo rỗng
- Gồm 3 hạt: proton, neutron, electron
Trả lời:
- Nguyên tử có kích thước vô cùng nhỏ, cấu tạo rỗng.
- Gồm 3 hạt:
+ Proton mang điện tích dương
+ Neutron không mang điện
+ Electron mang điện tích âm
1. Quan niệm ban đầu về nguyên tử
Câu hỏi trang 14 KHTN lớp 7: Theo Đê – mô – crit và Đan – tơn, nguyên tử được quan niệm như thế nào?
Phương pháp giải:
- Theo Đê – mô – crit: sự tồn tại của một loại hạt vô cùng nhỏ (được gọi là nguyên tử) tạo nên sự đa dạng của vạn vật. Khởi nguồn của quan niệm nguyên tử là sự chia nhỏ một vật sẽ đến một giới hạn “không thể phân chia được”
- Theo Đan – tơn: Khi tiến hành các thí nghiệm hóa học, ông nhận thấy các chất tác dụng vừa đủ với nhau theo các lượng xác định. Điều đó chứng tỏ rằng có các đơn vị chất tối thiểu (được gọi là nguyên tử) để chúng kết hợp vừa đủ với nhau
Trẩ lời:
- Theo Đê – mô – crit: Nguyên tử là một loại hạt vô cùng nhỏ, tạo nên sự đa dạng của vạn vật. Nguyên tử là loại hạt nhỏ nhất của một vật
- Theo Đan – tơn: Tồn tại các đơn vị chất tối thiểu (được gọi là nguyên tử) để chúng kết hợp vừa đủ với nhau.
2. Mô hình nguyên tử của Rơ-dơ-pho – Bo
Hoạt động trang 16 KHTN 7: Thảo luận nhóm và trả lời câu hỏi
1. Các đường tròn bằng giấy màu vàng biểu diễn gì?
2. Em hãy cho biết số electron có trong lớp electron thứ nhất và thứ hai của nguyên tử carbon và chỉ ra lớp electron đã chứa tối đa electron
Phương pháp giải:
1. Nguyên tử gồm 2 phần: lớp vỏ và hạt nhân
2.
- Nguyên tử carbon có 6 electron.
- Lớp thứ nhất chứa tối đa 2 electron và bị hạt nhân hút mạnh nhất
- Lớp thứ 2 chứa tối đa 8 electron
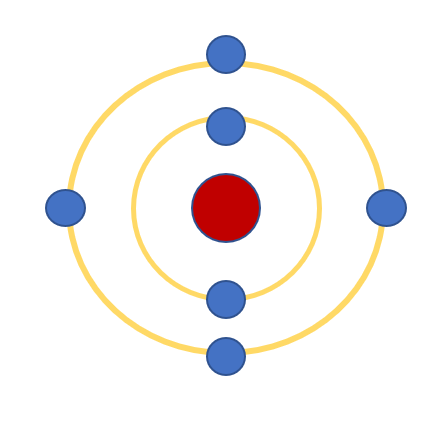
Trả lời:
1.
Các đường tròn bằng giấy màu vàng biểu diễn lớp electron của nguyên tử
2.
- Quan sát mô hình nguyên tử carbon, nhận thấy:
+ Lớp thứ nhất: chứa 2 electron
+ Lớp thứ hai: chứa 4 electron
=> Lớp thứ nhất đã chứa tối đa electron (2 electron)
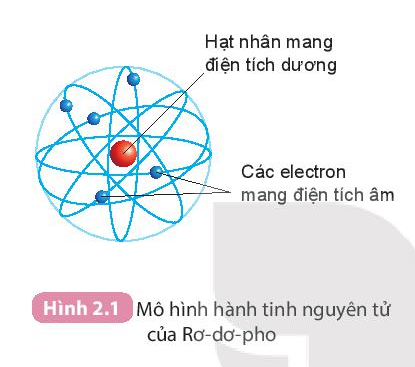
Câu hỏi 1 trang 16 KHTN lớp 7: Quan sát Hình 2.1 và cho biết các thành phần cấu tạo nên nguyên tử.
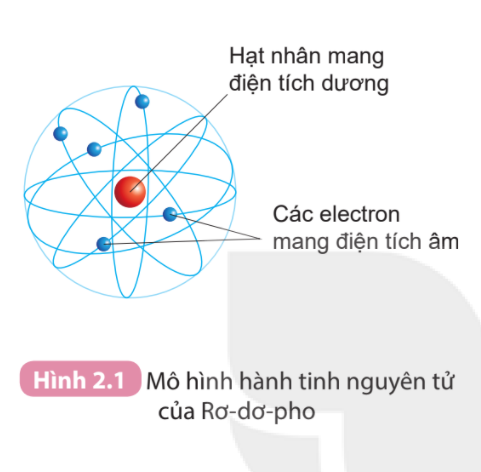
Phương pháp giải:
Nguyên tử được cấu tạo từ hạt nhân mang điện tích dương và các electron mang điện tích âm
Trả lời:
Dựa vào Hình 2.1, thành phần cấu tạo nên nguyên tử gồm:
+ Hạt nhân nằm ở tâm, mang điện tích dương
+ Các electron mang điện tích âm, chuyển động xung quanh hạt nhân như các hành tinh quay xung quanh mặt trời
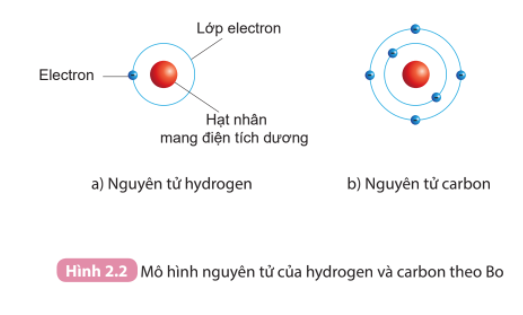
Phương pháp giải:
- Nguyên tử hydrogen: Hạt nhân mang điện tích dương, chỉ có 1 lớp electron và chứa 1 electron
- Nguyên tử carbon: Hạt nhân mang điện tích dương, có 2 lớp electron và có tổng 6 electron
Trả lời:
Áp dụng mô hình nguyên tử của Bo
- Nguyên tử hydrogen:
+ Hạt nhân nằm ở tâm, mang điện tích dương
+ Có 1 electron (mang điện tích âm) nằm ở lớp thứ nhất, quay xung quanh hạt nhân
- Nguyên tử carbon:
+ Hạt nhân nằm ở tâm, mang điện tích dương
+ Có 2 lớp electron và 6 electron phân bố ở các lớp: lớp thứ nhất có 2 electron, lớp thứ 2 có 4 electron. Các electron quay xung quanh hạt nhân.
3. Cấu tạo nguyên tử
Câu hỏi trang 16 KHTN lớp 7: Quan sát Hình 2.4 và cho biết
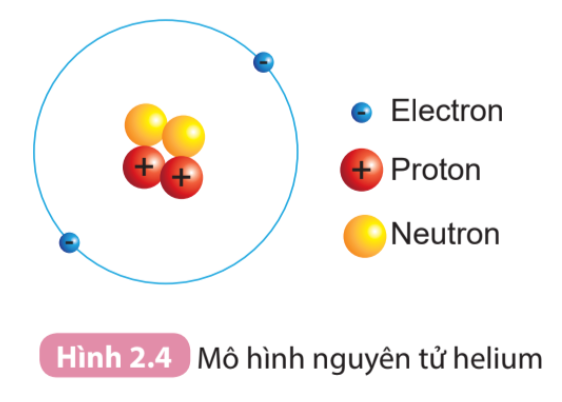
1. Hạt nhân nguyên tử có một hay nhiều hạt? Các hạt đó thuộc cùng một loại hạt hay nhiều loại hạt?
2. Số đơn vị điện tích hạt nhân của helium bằng bao nhiêu?
Phương pháp giải:
1. Quan sát Hình 2.4 có thể thấy rằng: hạt nhân bao gồm nhiều hạt, các hạt đó thuộc nhiều loại hạt
2. Số đơn vị điện tích hạt nhân bằng tổng số hạt proton có trong hạt nhân
Trả lời:
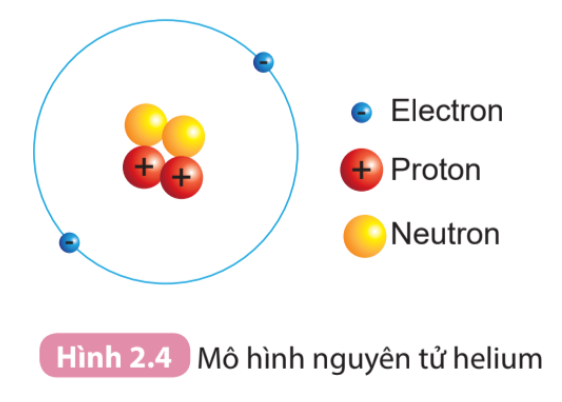
1.
Quan sát Hình 2.4:
- Hạt nhân nguyên tử gồm nhiều hạt: 2 hạt proton và 2 hạt neutron
- Các hạt đó thuộc nhiều loại hạt, đó là: proton (màu đỏ), neutron (màu vàng)
2.
- Số đơn vị điện tích hạt nhân (Z) bằng tổng số hạt proton trong hạt nhân
- Trong Hình 2.4, Helium có 2 proton (hạt màu đỏ)
=> Số đơn vị điện tích hạt nhân của helium là: Z = 2
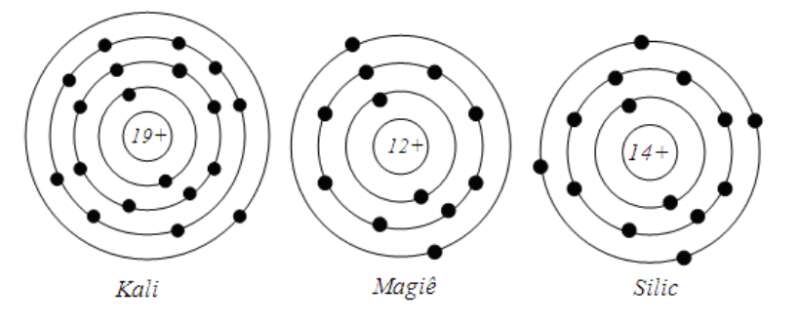
1. So sánh số electron trên từng lớp electron tương ứng trong các nguyên tử trên.
2. Số electron ở lớp electron ngoài cùng của vỏ mỗi nguyên tử trên đã được điền tối đa chưa? Cần thêm bao nhiêu electron để lớp electron ngoài cùng của mỗi nguyên tử trên có số electron tối đa?
Phương pháp giải:
1.
- Proton mang điện tích dương, nằm ở trong hạt nhân
- Electron mang điện tích âm, sắp xếp thành từng lớp
- Số lớp electron = số đường tròn bao quanh hạt nhân
- Số electron ở lớp electron ngoài cùng = số quả cầu ở đường tròn ngoài cùng
2.
- Lớp thứ nhất chứa tối đa 2 electron
- Lớp thứ hai chứa tối đa 8 electron
Trả lời:
1.
|
Nguyên tử |
Số proton trong hạt nhân |
Số electron trong vỏ nguyên tử |
Số lớp electron |
Số electron ở lớp electron ngoài cùng |
|
Carbon |
6 |
6 |
2 |
4 |
|
Oxygen |
8 |
8 |
2 |
6 |
|
Nitrogen |
7 |
7 |
2 |
5 |
2.
- Các nguyên tử carbon, nitrogen, oxygen đều có 2 lớp electron
- Lớp thứ 2 chứa tối đa 8 electron
+ Nguyên tử carbon có 4 electron ở lớp thứ 2 => Chưa được điền tối đa => Cần thêm 4 electron để lớp electron ngoài cùng có số electron tối đa
+ Nguyên tử oxygen có 6 electron ở lớp thứ 2 => Chưa được điền tối đa => Cần thêm 2 electron để lớp electron ngoài cùng có số electron tối đa
+ Nguyên tử nitrogen có 5 electron ở lớp thứ 2 => Chưa được điền tối đa => Cần thêm 3 electron để lớp electron ngoài cùng có số electron tối đa
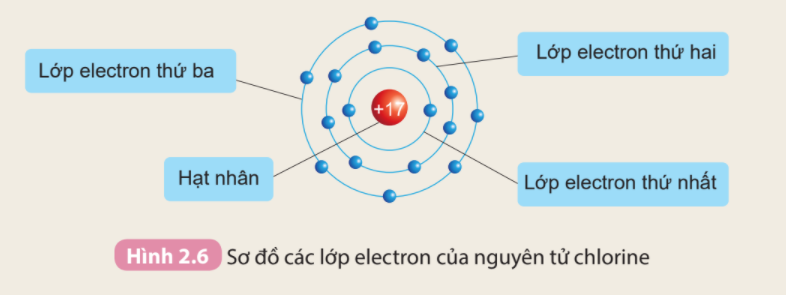
Câu hỏi trang 18 KHTN lớp 7: Quan sát Hình 2.6 và cho biết:
1. Thứ tự sắp xếp các electron ở vỏ nguyên tử chlorine
2. Số electron trên từng lớp ở vỏ nguyên tử chlorine
Phương pháp giải:
1. Các electron sắp xếp vào các lớp theo thứ tự từ trong ra ngoài cho đến hết
2. Số electron trên từng lớp ở vỏ nguyên tử chlorine là số quả cầu trên các đường tròn
Trả lời:
1.
- Các electron sắp xếp thành từng lớp theo thứ tự từ trong ra ngoài: Lớp thứ nhất (lớp trong cùng) → Lớp thứ 2 → Lớp thứ 3
2.
- Số electron trên từng lớp ở vỏ nguyên tử chlorine:
+ Lớp thứ nhất có 2 electron
+ Lớp thứ hai có 8 electron
+ Lớp thứ ba có 7 electron
4. Khối lượng nguyên tử
Phương pháp giải:
- Khối lượng nguyên tử bằng tổng khối lượng của các hạt proton, neutron trong hạt nhân và các hạt electron ở vỏ nguyên tử
- Khối lượng hạt nhân nguyên tử bằng tổng khối lượng của các hạt proton, neutron
Trả lời:
- Ta có:
+ Khối lượng 1 proton = 1 neutron = 1amu
+ Khối lượng 1 electron = 0,00055 amu
=> Khối lượng electron nhỏ hơn rất nhiều so với khối lượng proton và neutron
=> Có thể bỏ qua khối lượng của electron hay khối lượng hạt nhân nguyên tử có thể coi là khối lượng của nguyên tử
- Ví dụ: Xét nguyên tử helium có 2p, 2n và 2e
+ Khối lượng nguyên tử = 2p + 2n + 2e = 2.1 + 2.1 + 2.0,00055 = 4,0011 ≈ 4
+ Khối lượng hạt nhân = 2p + 2n = 2.1 + 2.1 = 4
Phương pháp giải:
Khối lượng 1 proton = 1 neutron = 1amu
Khối lượng 1 electron = 0,00055 amu
Trả lời:
- Ở câu hỏi 1 ta biết rằng khối lượng hạt nhân nguyên tử có thể coi là khối lượng của nguyên tử
- Khối lượng hạt nhân nguyên tử bằng tổng khối lượng của các hạt proton, neutron trong hạt nhân
- Mà: Khối lượng 1 proton = 1 neutron = 1amu
=> Khối lượng nguyên tử nhôm (13p, 14n) = 13.1 + 14.1 = 27 amu
Khối lượng nguyên tử đồng (29p, 36n) = 29.1 + 36.1 = 65 amu

Em có thể trang 18 KHTN lớp 7: Làm được mô hình một số nguyên tử theo mô hình nguyên tử Bo
Trả lời:
Lý thuyết KHTN 7 Bài 2: Nguyên tử
I. Quan niệm ban đầu về nguyên tử
- Theo Đê – mô – crit: sự tồn tại của một loại hạt vô cùng nhỏ (được gọi là nguyên tử) tạo nên sự đa dạng của vạn vật. Khởi nguồn của quan niệm nguyên tử là sự chia nhỏ một vật sẽ đến một giới hạn “không thể phân chia được”.
- Theo Đan – tơn: Có các đơn vị chất tối thiểu (được gọi là nguyên tử) để các chất tác dụng vừa đủ với nhau theo các lượng xác định.
II. Mô hình nguyên tử của Rơ-dơ-pho – Bo
- Rơ-dơ-pho (E.Rutherford) (1871 – 1937), nhà vật lí người Niu-di-lân (New ZeaLand) đã đề xuất mô hình nguyên tử như sau:
+ Nguyên tử có cấu tạo rỗng.
+ Nguyên tử gồm: Hạt nhân ở tâm mang điện tích dương và các electron mang điện tích âm.
+ Các electron chuyển động xung quanh hạt nhân như các hành tinh quay xung quanh Mặt Trời.
- Bo (N. Bohr) (1885 – 1962), nhà vật lí người Đan Mạch, đã hoàn thiện mô hình nguyên tử của Rơ-dơ-pho như sau:
+ Các electron chuyển động xung quanh hạt nhân theo từng lớp khác nhau.
+ Lớp electron trong cùng chứa tối đa 2 electron và bị hạt nhân hút mạnh nhất.
+ Các lớp electron khác chứa tối đa 8 electron hoặc nhiều hơn và bị hạt nhân hút yếu hơn.
Ví dụ:
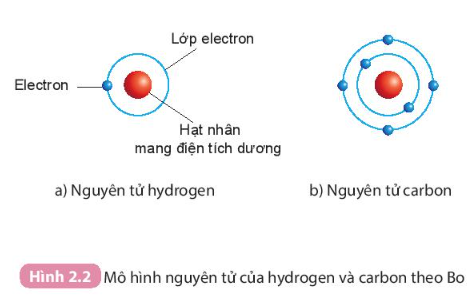
Theo mô hình nguyên tử của Bo
- Nguyên tử carbon gồm:
+ Hạt nhân ở tâm mang điện tích dương.
+ Có 6 electron chuyển động xung quanh hạt nhân và được sắp xếp thành hai lớp:
Lớp thứ nhất (lớp trong cùng gần hạt nhân nhất) có 2 electron.
Lớp thứ hai có 4 electron.
Mở rộng: Lịch sử tìm ra các hạt tạo nên nguyên tử
- Bằng các thí nghiệm vật lí, Tôm-xơn (J.J.Thomson) (1856-1940), nhà vật lí người Anh, đã xác định được electron, kí hiệu là e, là một thành phần tạo nên nguyên tử và mang điện tích âm.
- Qua thí nghiệm bắn phá lá vàng, Rơ-dơ-pho đã xác định được nguyên tử có cấu tạo rỗng và có hạt nhân ở tâm.
- Bằng cách bắn phá các hạt nhân nguyên tử, Rơ-dơ-pho đã tìm ra hạt proton mang điện tích dương và Chat-uých (J.Chadwick) đã tìm ra hạt neutron không mang điện, đó là các hạt tạo nên hạt nhân nguyên tử.
III. Cấu tạo nguyên tử
1. Hạt nhân nguyên tử
- Nguyên tử có kích thước vô cùng nhỏ, chỉ khoảng một phần mười tỉ mét. Kích thước của hạt nhân còn nhỏ hơn nữa và chỉ bằng khoảng một phần mười ngàn kích thước của nguyên tử.
- Hạt nhân nguyên tử được tạo thành từ các hạt proton và neutron.
+ Hạt proton kí hiệu là p. Mỗi hạt proton mang một đơn vị điện tích dương, quy ước là +1.
+ Hạt neutron khí hiệu n. Hạt neutron không mang điện.
- Số đơn vị điện tích hạt nhân, kí hiệu là Z, bằng tổng số proton có trong hạt nhân.
Ví dụ:
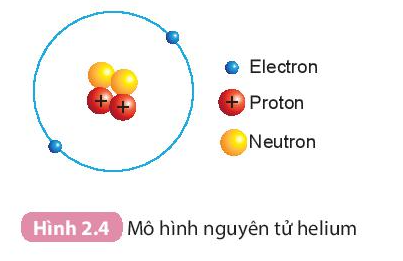
- Hạt nhân nguyên tử helium có 2p, 2n.
- Helium có 2 proton trong hạt nhân ⇒ Số đơn vị điện tích hạt nhân của helium bằng 2.
2. Vỏ nguyên tử
- Vỏ nguyên tử được cấu tạo nên bởi các electron, kí hiệu là e.
- Mỗi electron mang một đơn vị điện tích âm, quy ước là -1.
- Các electron được sắp xếp thành từng lớp:
+ Lớp thứ nhất (trong cùng, gần hạt nhân nhất) có tối đa 2 electron;
+ Lớp thứ hai có tối đa 8 electron…
- Các electron sắp xếp vào các lớp theo thứ tự từ trong ra ngoài cho đến hết.
- Các electron lớp ngoài cùng quyết định tính chất hóa học của nguyên tử.
Ví dụ:
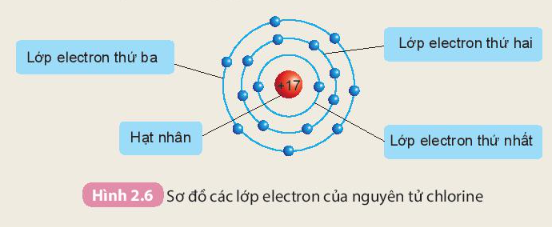
Nguyên tử chlorine có 17 electron
- Các electron sắp xếp thành từng lớp theo thứ tự từ trong ra ngoài cho đến hết:
+ Lớp electron thứ nhất ở trong cùng, gần hạt nhân nhất có 2 electron.
+ Lớp electron thứ hai ở bên ngoài lớp thứ nhất có 8 electron.
+ Lớp electron thứ ba ở ngoài cùng có 7 electron.
Kết luận:
- Nguyên tử là hạt vô cùng nhỏ tạo nên các chất.
- Nguyên tử gồm hạt nhân mang điện tích dương và vỏ nguyên tử mang điện tích âm.
- Nguyên tử trung hòa và điện nên tổng số hạt proton bằng tổng số hạt electron.
IV. Khối lượng nguyên tử
- Khối lượng nguyên tử bằng tổng khối lượng của các hạt proton, neutron trong hạt nhân và các hạt electron ở vỏ nguyên tử.
- Khối lượng nguyên tử vô cùng nhỏ, để thuận tiện cho việc sử dụng, người ta dùng đơn vị khối lượng nguyên tử, viết tắt là amu.
- Khối lượng 1 proton ≈ khối lượng 1 neutron ≈ 1 amu.
Khối lượng 1 electron ≈ 0,00055 amu nhỏ hơn rất nhiều so với khối lượng của proton và neutron.
⇒ Coi khối lượng hạt nhân nguyên tử là khối lượng của nguyên tử.
Ví dụ: Nguyên tử đồng có 29 proton, 29 electron, 35 neutron
Coi khối lượng hạt nhân nguyên tử là khối lượng của nguyên tử.
⇒ Khối lượng của nguyên tử đồng là 29.1amu + 35.1 amu = 64 amu
Xem thêm các bài giải SGK Khoa học tự nhiên lớp 7 Kết nối tri thức hay, chi tiết khác:
Bài 1: Phương pháp và kĩ năng học tập môn Khoa học tự nhiên
Bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Bài 5: Phân tử - Đơn chất - Hợp chất