Với giải Câu hỏi trang 18 Khoa học tự nhiên lớp 7 Kết nối tri thức với cuộc sống chi tiết trong Bài 2: Nguyên tử giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Khoa học tự nhiên 7. Mời các bạn đón xem:
Giải bài tập Khoa học tự nhiên lớp 7 Bài 2: Nguyên tử
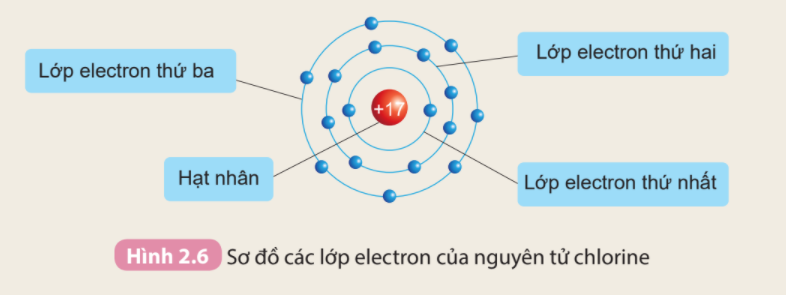
Câu hỏi trang 18 KHTN lớp 7: Quan sát Hình 2.6 và cho biết:
1. Thứ tự sắp xếp các electron ở vỏ nguyên tử chlorine
2. Số electron trên từng lớp ở vỏ nguyên tử chlorine
Phương pháp giải:
1. Các electron sắp xếp vào các lớp theo thứ tự từ trong ra ngoài cho đến hết
2. Số electron trên từng lớp ở vỏ nguyên tử chlorine là số quả cầu trên các đường tròn
Trả lời:
1.
- Các electron sắp xếp thành từng lớp theo thứ tự từ trong ra ngoài: Lớp thứ nhất (lớp trong cùng) → Lớp thứ 2 → Lớp thứ 3
2.
- Số electron trên từng lớp ở vỏ nguyên tử chlorine:
+ Lớp thứ nhất có 2 electron
+ Lớp thứ hai có 8 electron
+ Lớp thứ ba có 7 electron
Lý thuyết Cấu tạo nguyên tử
1. Hạt nhân nguyên tử
- Nguyên tử có kích thước vô cùng nhỏ, chỉ khoảng một phần mười tỉ mét. Kích thước của hạt nhân còn nhỏ hơn nữa và chỉ bằng khoảng một phần mười ngàn kích thước của nguyên tử.
- Hạt nhân nguyên tử được tạo thành từ các hạt proton và neutron.
+ Hạt proton kí hiệu là p. Mỗi hạt proton mang một đơn vị điện tích dương, quy ước là +1.
+ Hạt neutron khí hiệu n. Hạt neutron không mang điện.
- Số đơn vị điện tích hạt nhân, kí hiệu là Z, bằng tổng số proton có trong hạt nhân.
Ví dụ:
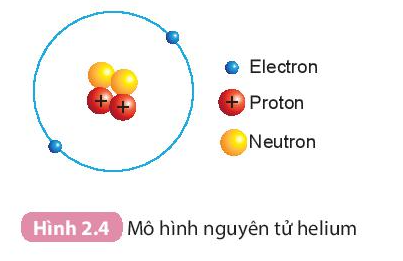
- Hạt nhân nguyên tử helium có 2p, 2n.
- Helium có 2 proton trong hạt nhân ⇒ Số đơn vị điện tích hạt nhân của helium bằng 2.
2. Vỏ nguyên tử
- Vỏ nguyên tử được cấu tạo nên bởi các electron, kí hiệu là e.
- Mỗi electron mang một đơn vị điện tích âm, quy ước là -1.
- Các electron được sắp xếp thành từng lớp:
+ Lớp thứ nhất (trong cùng, gần hạt nhân nhất) có tối đa 2 electron;
+ Lớp thứ hai có tối đa 8 electron…
- Các electron sắp xếp vào các lớp theo thứ tự từ trong ra ngoài cho đến hết.
- Các electron lớp ngoài cùng quyết định tính chất hóa học của nguyên tử.
Ví dụ:
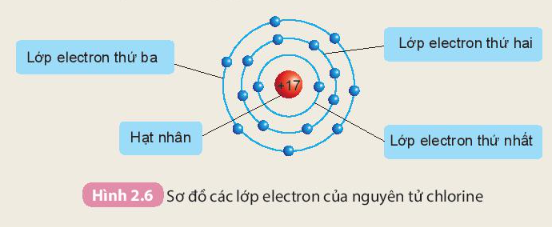
Nguyên tử chlorine có 17 electron
- Các electron sắp xếp thành từng lớp theo thứ tự từ trong ra ngoài cho đến hết:
+ Lớp electron thứ nhất ở trong cùng, gần hạt nhân nhất có 2 electron.
+ Lớp electron thứ hai ở bên ngoài lớp thứ nhất có 8 electron.
+ Lớp electron thứ ba ở ngoài cùng có 7 electron.
Kết luận:
- Nguyên tử là hạt vô cùng nhỏ tạo nên các chất.
- Nguyên tử gồm hạt nhân mang điện tích dương và vỏ nguyên tử mang điện tích âm.
- Nguyên tử trung hòa và điện nên tổng số hạt proton bằng tổng số hạt electron.
Xem thêm các bài giải Khoa học tự nhiên lớp 7 Kết nối tri thức hay, chi tiết khác:
Câu hỏi trang 14 KHTN lớp 7: Theo Đê – mô – crit và Đan – tơn, nguyên tử được quan niệm như thế nào?...
Hoạt động trang 16 KHTN 7: Thảo luận nhóm và trả lời câu hỏi...
Câu hỏi 1 trang 16 KHTN lớp 7: Quan sát Hình 2.1 và cho biết các thành phần cấu tạo nên nguyên tử....
Câu hỏi trang 16 KHTN lớp 7: Quan sát Hình 2.4 và cho biết...
Xem thêm các bài giải SGK Khoa học tự nhiên lớp 7 Kết nối tri thức hay, chi tiết khác:
Bài 1: Phương pháp và kĩ năng học tập môn Khoa học tự nhiên
Bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Bài 5: Phân tử - Đơn chất - Hợp chất