Với giải Luyện tập 4 trang 126 Hóa học lớp 12 Cánh diều chi tiết trong Bài 18: Nguyên tố nhóm IIA giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 18: Nguyên tố nhóm IIA
Luyện tập 4 trang 126 Hóa học 12: Vì sao khi có sự gia tăng nồng độ của carbon dioxide trong nước biển thì các rạn san hô và núi đá vôi có thể bị phá huỷ, xói mòn?
Phần núi đá vôi trong nước biển dễ bị xói mòn
Lời giải:
Các rạn san hô và núi đá vôi có thành phần chính là CaCO3.
Mà CaCO3 phản ứng được với nước có carbon dioxide hòa tan theo phương trình hóa học:
CaCO3(s) + H2O(l) + CO2(aq) ⇌ Ca(HCO3)2(aq)
Khi tăng nồng độ của carbon dioxide trong nước biển thì cân bằng hóa học trên sẽ chuyển dịch theo chiều làm giảm nồng độ của carbon dioxide, tức là chiều của phản ứng thuận. Nên lượng CaCO3(s) bị giảm đi.
Do đó, khi có sự gia tăng nồng độ của carbon dioxide trong nước biển thì các rạn san hô và núi đá vôi có thể bị phá huỷ, xói mòn.
Lý thuyết Hợp chất của các nguyên tố nhóm IIA
1. Độ tan của một số loại hợp chất
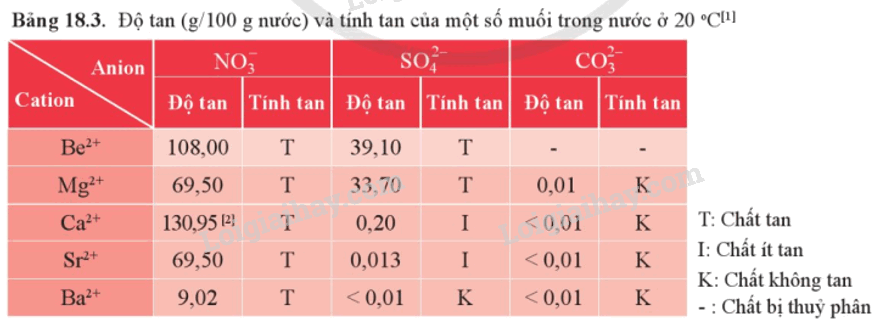
2. Một số loại muối phổ biến
a) Muối carbonate
- Muối carbonate của các nguyên tố Mg, Ca, Sr, Ba phản ứng với dung dịch acid, với nước có carbon dioxide hòa tan.
Ví dụ: CaCO3(s) + 2HCl(aq) CaCl2(aq) + H2O(l) + CO2(g)
CaCO3(s) + H2O(l) + CO2(aq) Ca(HCO3)2(aq)
- Các muối carbonate bị nhiệt phân, tạo thành oxide kim loại và khí carbon dioxide:
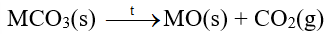
b) Muối nitrate
- Các muối nitrate của nguyên tố nhóm IIA bị nhiệt phân tạo oxide kim loại, khí nitrogen dioxide và oxygen.
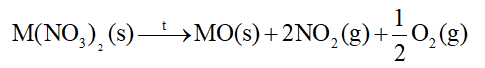
- Độ bền nhiệt của các muối nitrate có xu hướng tăng từ Mg(NO3)2 đến Ba(NO3)2.
3. Kiểm tra sự có mặt của ion trong dung dịch
Để nhận biết sự có mặt của mỗi ion Ca2+, Mg2+, CO32- hay SO42- trong dung dịch, người ta quan sát hiện tượng xảy ra như kết tủa, sủi bọt khí khi cho các chất phù hợp vào dung dịch.
4. Ứng dụng và vai trò của một số hợp chất của calcium
a) Ứng dụng của một số hợp chất của calcium có trong tự nhiên
thạch cao, apatite, đá vôi, vôi sống, vôi tôi có thành phần chính là các hợp chất của calcium. Chúng là nguyên liệu, vật liệu phổ biến và có nhiều ứng dụng trong đời sống, sản xuất.

b) Vai trò của hợp chất calcium trong cơ thể người
Trong cơ thể người:
+ Một số hợp chất không tan của calcium cấu tạo nên xương và răng, giúp phát triển, ổn định xương và răng.
+ Một số hợp chất tan của calcium giúp ổn định chức năng truyền dẫn tín hiệu thần kinh đến tế bào, chức năng co giãn của cơ bắp.
Xem thêm lời giải bài tập Hóa học lớp 12 Cánh diều hay, chi tiết khác:
Câu hỏi 3 trang 124 Hóa học 12: Vì sao magnesium phȧn ứng rất chậm với nước?...
Thí nghiệm 1 trang 125 Hóa học 12: So sánh độ tan của muối BaSO4 và CaSO4...
Câu hỏi 4 trang 125 Hóa học 12: Phản ứng giữa các chất nào sau đây tạo ra chất không tan?...
Thí nghiệm 2 trang 127 Hóa học 12: Thí nghiệm kiểm tra sự có mặt của các ion Ca2+, Ba2+, , ...
Xem thêm các bài giải bài tập Hóa Học lớp 12 Cánh diều hay, chi tiết khác:
Bài 19. Nước cứng và làm mềm nước cứng
Bài 20. Sơ lược về kim lại chuyển tiếp dãy thứ nhất
Bài 22. Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch