Lời giải bài tập Hóa học lớp 12 Bài 22: Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch sách Cánh diều hay, chi tiết sẽ giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập môn Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 22: Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch
Hãy dự đoán hiện tượng xảy ra khi thêm từ từ cho đến dư dung dịch ammonia vào ống nghiệm chứa dung dịch copper(II) sulfate. Giải thích.
Lời giải:
Hiện tượng: Xuất hiện kết tủa màu xanh nhạt, lượng kết tủa tăng dần đến không đổi. Sau đó, kết tủa tan dần đến hết, dung dịch từ màu xanh nhạt chuyển sang màu xanh lam.
Giải thích:
- Dung dịch copper(II) sulfate có màu xanh do Cu2+ tạo phức chất aqua với nước.
Cu2+(aq) + 6H2O(l) ⟶ [Cu(OH2)6]2+(aq)
- Thêm vài giọt dung dịch ammonia (NH3) có môi trường kiềm.
NH3 + H2O ⇌ + OH−
Khi đó ion OH− thay thế phối tử H2O trong [Cu(OH2)6]2+(aq) tạo kết tủa [Cu(OH)2(OH2)4] có màu xanh nhạt.
- Khi lượng [Cu(OH2)6]2+(aq) hết, kết tủa [Cu(OH)2(OH2)4] đạt đến cực đại. NH3 dư tiếp tục thay thế phối tử OH− và H2O trong [Cu(OH)2(OH2)4] làm cho kết tủa tan dần và hình thành phức chất [Cu(NH3)4(OH2)2]2+(aq) có màu xanh lam.
Lời giải:
Phức chất aqua có dạng hình học bát diện được hình thành khi cho CrCl3 vào nước tức là nguyên tử trung tâm Cr3+ tạo 6 liên kết σ với 6 phân tử nước.
Phương trình hoá học của quá trình tạo phức khi cho CrCl3 vào nước:
CrCl3(aq) + 6H2O(l) ⟶ [Cr(OH2)6]Cl3(aq)
Hay Cr3+(aq) + 6H2O(l) ⟶ [Cr(OH2)6]3+(aq)
Câu hỏi trang 148 Hóa học 12: Trong Ví dụ 4 và Ví dụ 5, hãy cho biết:
a) Phối tử thay thế và phối tử bị thay thế.
b) Dấu hiệu của phản ứng tạo phức chất có thể là gì?
Lời giải:
Trong Ví dụ 4:
a) Phối tử thay thế là NH3, phối tử bị thay thế là H2O
b) Dấu hiệu của phản ứng tạo phức chất là sự biến đổi màu của dung dịch.
Trong Ví dụ 5:
a) Phối tử thay thế là NH3, phối tử bị thay thế là Cl-
b) Dấu hiệu của phản ứng tạo phức chất là sự tạo kết tủa.
Thí nghiệm 1 trang 148 Hóa học 12: Phản ứng copper(II) sulfate với dung dịch ammonia
Chuẩn bị:
- Hóa chất: Dung dịch CuSO4 2%, dung dịch NH3 khoảng 10%.
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt.
Tiến hành: Cho từ từ từng giọt dung dịch NH3 vào ống nghiệm chứa 5 mL dung dịch CuSO4. Lắc ống nghiệm trong quá trình thêm dung dịch NH3. Khi dung dịch trong ống nghiệm chuyển sang màu xanh lam thì dừng thêm dung dịch NH3.
Yêu cầu: Quan sát và giải thích hiện tượng. Viết phương trình hóa học của phản ứng xảy ra.
Lời giải:
Hiện tượng: Xuất hiện kết tủa màu xanh nhạt, lượng kết tủa tăng dần đến không đổi. Sau đó, kết tủa tan dần đến hết, dung dịch từ màu xanh nhạt chuyển sang màu xanh lam.
Giải thích:
- Thêm vài giọt dung dịch ammonia (NH3) có môi trường kiềm.
NH3 + H2O ⟶ + OH−
Khi đó ion OH− thay thế phối tử H2O trong [Cu(OH2)6]2+(aq) tạo kết tủa [Cu(OH)2(OH2)4] có màu xanh nhạt.
- Khi lượng [Cu(OH2)6]2+(aq) hết, kết tủa [Cu(OH)2(OH2)4] đạt đến cực đại. NH3 dư tiếp tục thay thế phối tử OH− và H2O trong [Cu(OH)2(OH2)4] làm cho kết tủa tan dần và hình thành phức chất [Cu(NH3)4(OH2)2]2+(aq) có màu xanh lam.
Phương trình hóa học:
[Cu(OH2)6]2+(aq) + 2OH−(aq) ⟶ [Cu(OH)2(OH2)4](s) + 2H2O(l)
[Cu(OH)2(OH2)4](s) + 4NH3(aq) ⟶ [Cu(NH3)4(OH2)2]2+(aq) + 2OH−(aq) + 2H2O(l)
Chuẩn bị:
- Hóa chất: Dung dịch CuSO4 0,5%, dung dịch HCl đặc.
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt.
Tiến hành: Thêm khoảng 2 mL dung dịch HCl vào ống nghiệm chứa khoảng 1 mL dung dịch CuSO4.
Yêu cầu: Quan sát và giải thích hiện tượng. Viết phương trình hóa học của phản ứng xảy ra.
Lời giải:
Hiện tượng: Màu xanh của dung dịch chuyển sang màu vàng.
Giải thích: Do ion Cl− thay thế phối tử H2O trong phức aqua của Cu2+
Phương trình hóa học:
Cu2+(aq) + 6H2O(l) ⟶ [Cu(OH2)6]2+(aq)
[Cu(OH2)6]2+(aq) + 4Cl−(aq) ⇌ [CuCl4]2−(aq) + 6H2O(l)
Lời giải:
Ứng dụng trong hóa học của phức chất [Cu(NH3)4(OH2)2]2+:
- Xác định sự có mặt hàm lượng cation Cu2+ trong dung dịch dựa vào phản ứng tạo phức chất [Cu(NH3)4(OH2)2]2+ có màu xanh lam.
- Dùng để tinh chế và phân tích trọng lượng phân tử của cellulose do có khả năng hòa tan cellulose.
- Làm chất tạo màu, thuốc nhuộm vải do có màu xanh lam đặc trưng.
Bài tập
Bài 1 trang 150 Hóa học 12: Hoàn thành phản ứng dưới đây:
NiCl2(s) + ? ⟶ [Ni(OH2)6]2+(aq) + ?
Lời giải:
NiCl2(s) + 6H2O(l) ⟶ [Ni(OH2)6]2+(aq) + 2Cl−(aq)
[Cu(OH2)6]2+(aq) + 4Cl−(aq) ⇌ [CuCl4]2−(aq) + 6H2O(l)
Màu xanh Màu vàng
Lời giải:
Khi tăng nồng độ Cl−(aq), cân bằng sẽ chuyển dịch theo chiều làm giảm nồng độ Cl−(aq), tức là chiều tạo phức [CuCl4]2−(aq).
Do đó việc tăng nồng độ Cl−(aq) làm cho màu vàng của dung dịch trở lên đậm hơn.
Bài 3 trang 150 Hóa học 12: Phản ứng nào dưới đây là phản ứng thay thế phối tử trong phức chất?
a) [Co(OH2)6]3+(aq) + 6NH3(aq) ⟶ [Co(NH3)6]3+(aq) + 6H2O(l)
b) 2Na[Au(CN)2](aq) + Zn(s) ⟶ Na2[Zn(CN)4](aq) + 2Au(s)
c) [Co(OH2)6]2+(aq) + 4Cl−(aq) ⇌ [CoCl4]2−(aq) + 6H2O(l)
Lời giải:
Phản ứng thay thế phối tử trong phức chất là:
a) Phối tử NH3 thay thế cho phối tử H2O trong phức chất.
c) Phối tử Cl− thay thế cho phối tử H2O trong phức chất.
Còn phản ứng b là phản ứng thay thế nguyên tử trung tâm Au bằng Zn.
Lý thuyết Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch
I. Sự hình thành phức chất aqua của cation kim loại chuyển tiếp trong dung dịch
- Khi tan trong nước, muối của các kim loại chuyển tiếp phân li thành các ion. Sau đó, cation kim loại chuyển tiếp (Mn+) thường nhận các cặp electron hóa trị riêng từ các phân tử H2O để hình thành các liên kết cho – nhận, tạo ra phức chất aqua theo phương trình hóa học tổng quát sau:;
Mn+(aq) + m H2O(l) [M(OH2)m]n+(aq)
+ Với: n là giá trị điện tích của cation kim loại M
m là số phối tử H2O
[M(OH2)m]n+ là công thức tổng quát của phức chất aqua của Mn+.
II. Dấu hiệu của phản ứng tạo phức chất trong dung dịch
Các phản ứng tạo phức chất thường có một số dấu hiệu dễ quan sát như sự biến đổi máu sắc, sự hòa tan, sự kết tủa. Trong các dấu hiệu trên, sự biến đổi màu sắc là phổ biến hơn cả
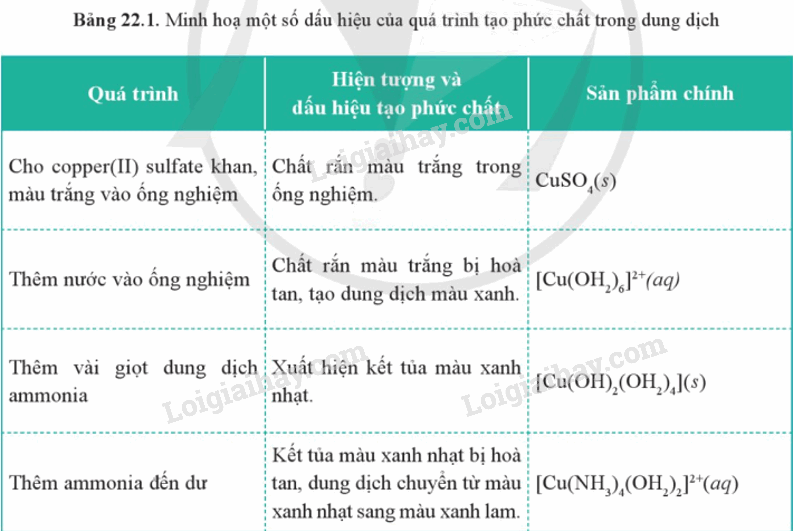
III. Phản ứng thay thế phối tử trong phức chất
Ở những điều kiện phù hợp, các anion và phân tử như OH-, X- (halide), NH3,…. Có thể thay thế được một, một số hoặc tất cả các phối tử trong phức chất
Ví dụ: [Cr(OH2)6]3+(aq) + 6OH-(aq) [Cr(OH)6]3-(aq) + 6H2O(l)
IV. Ứng dụng của phức chất
Các phức chất có nhiều ứng dụng trong hóa học, sản xuất và đời sống,…
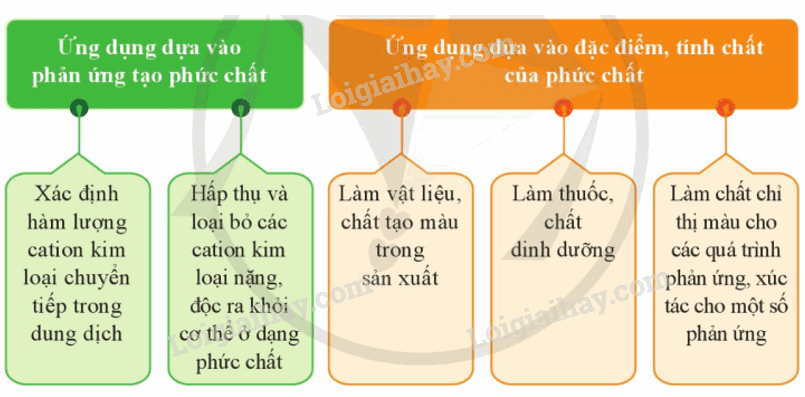
Sơ đồ tư duy Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch

Xem thêm các bài giải bài tập Hóa Học lớp 12 Cánh diều hay, chi tiết khác:
Bài 19. Nước cứng và làm mềm nước cứng
Bài 20. Sơ lược về kim lại chuyển tiếp dãy thứ nhất
Bài 22. Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch