Với giải Câu hỏi 3 trang 124 Hóa học lớp 12 Cánh diều chi tiết trong Bài 18: Nguyên tố nhóm IIA giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 18: Nguyên tố nhóm IIA
Câu hỏi 3 trang 124 Hóa học 12: Vì sao magnesium phȧn ứng rất chậm với nước?

Một số bọt khí hydrogen xuất hiện khi cho magnesium vào nước ở điều kiện thường
Lời giải:
Magnesium phȧn ứng rất chậm với nước là vì độ tan trong nước của Mg(OH)2 tạo thành là rất thấp (0,0012 g/100 g nước ở 20°C). Phần Mg(OH)2 không tan này bám trên bề mặt Mg làm cản trở quá trình tiếp xúc của Mg với nước.
Lý thuyết Đơn chất
1. Tính chất vật lí
- Bán kính nguyên tử và một số tính chất vật lí của kim loại nhóm IIA được thể hiện qua bảng sau:
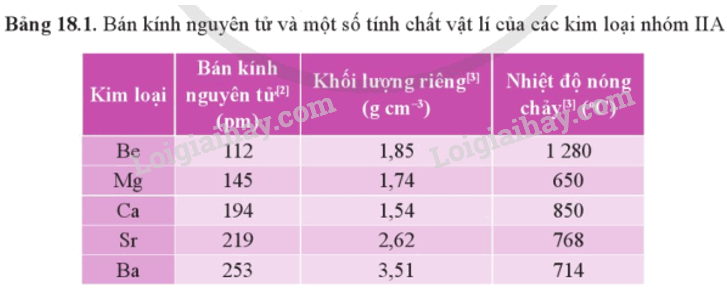
- Kim loại nhóm IIA thuộc nhóm kim loại nhẹ do có khối lượng riêng nhỏ. Chúng có nhiệt độ nóng chảy cao hơn so với kim loại nhóm IA, nhưng tương đối thấp so với các kim loại khác.
- Khác với kim loại kiềm, khối lượng riêng và nhiệt độ nóng chảy của kim loại nhóm IIA biến đổi không theo xu hướng rõ rệt.
2. Tính chất hóa học
a) Phản ứng với oxygen
Khi đốt nóng trong oxygen hoặc trong không khí, các kim loại nhóm IIA đều bốc cháy, tạo ra oxide theo phương trình hóa học tổng quát sau:
2M(s) + O2(g) 2MO(s)
Khi cháy, các kim loại nhóm IIA cho ngọn lửa có màu đặc trưng.
b) Phản ứng với nước
Be không tan trong nước, Mg phản ứng với nước rất chậm ở nhiệt độ thường, phản ứng mạnh hơn khi đun nóng. Ca, Sr, Ba phản ứng mạnh với nước ở nhiệt độ thường.
3. Ứng dụng
Ứng dụng cơ bản của một số kim loại nhóm IIA là tham gia tạo hợp kim.
Xem thêm lời giải bài tập Hóa học lớp 12 Cánh diều hay, chi tiết khác:
Mở đầu trang 121 Hóa học 12: Nguyên tố nhóm IIA và một số hợp chất của chúng có nhiều ứng dụng trong thực tiễn (Hình 18.1)....
Câu hỏi 1 trang 123 Hóa học 12: Trong cùng chu kì, kim loại nhóm IIA có tính khử mạnh hơn hay yếu hơn so với tính khử của kim loại nhóm IA? Giải thích....
Câu hỏi 2 trang 123 Hóa học 12: Dựa vào tính khử của kim loại và độ tan của các hydroxide, dự đoán:...
Câu hỏi 3 trang 124 Hóa học 12: Vì sao magnesium phȧn ứng rất chậm với nước?...
Vận dụng 1 trang 124 Hóa học 12: Tìm hiểu và cho biết, ngoài tham gia tạo hợp kim, các kim loại nhóm IIA còn có những ứng dụng nào khác....
Luyện tập 1 trang 124 Hóa học 12: Magnesium là kim loại cơ bản trong hợp kim dùng để chế tạo khung và cánh của các thiết bị bay (Hình 18.3). Theo em, ứng dụng trên dựa vào tính chất vật lí nào của hợp kim magnesium?...
Thí nghiệm 1 trang 125 Hóa học 12: So sánh độ tan của muối BaSO4 và CaSO4...
Câu hỏi 4 trang 125 Hóa học 12: Phản ứng giữa các chất nào sau đây tạo ra chất không tan?...
Luyện tập 2 trang 125 Hóa học 12: Vì sao các khoáng vật calcite, dolomite,... hầu như không tan trong nước?...
Câu hỏi 5 trang 126 Hóa học 12: Dùng nước có thể phân biệt MgCO3(s) và Mg(NO3)2(s) được không? Giải thích....
Luyện tập 3 trang 126 Hóa học 12: Một mẫu nước giếng có chứa các ion Ca2+, Na+, Mg2+, Cl- và . Viết phương trình hoá học của các phản ứng tạo chất không tan khi cho dung dịch soda vào mẫu nước giếng trên....
Luyện tập 4 trang 126 Hóa học 12: Vì sao khi có sự gia tăng nồng độ của carbon dioxide trong nước biển thì các rạn san hô và núi đá vôi có thể bị phá huỷ, xói mòn?...
Câu hỏi 6 trang 126 Hóa học 12: Dựa vào Bảng 18.4, hãy cho biết quá trình phân huỷ 1 mol muối carbonate của nguyên tố nhóm IIA nào cần hấp thu nhiều năng lượng hơn....
Thí nghiệm 2 trang 127 Hóa học 12: Thí nghiệm kiểm tra sự có mặt của các ion Ca2+, Ba2+, , ...
Vận dụng 2 trang 129 Hóa học 12: Tìm hiểu các triệu chứng của các bệnh về răng và xương có liên quan đến sự thiếu hụt calcium trong cơ thể. Đề xuất một số biện pháp để phòng tránh, hạn chế một số bệnh trên....
Bài 1 trang 130 Hóa học 12: Nêu các đặc điểm giống nhau và khác nhau về cấu tạo nguyên tử và tính chất giữa kim loại nhóm IIA với kim loại kiềm....
Bài 2 trang 130 Hóa học 12: Dựa vào giá trị thế điện cực chuẩn của kim loại (Bảng 10.1) và giá trị thế điện cực chuẩn của quá trình 2H2O + 2e ⇌ H2 + 2OH- với = – 0,413 V ở pH = 7, hãy :...
Bài 3 trang 130 Hóa học 12: Khi cho lượng soda phù hợp vào dung dịch có chứa cation Ca2+ và Mg2+ thì hai cation này sẽ bị tách ra khỏi dung dịch. Viết phương trình hoá học minh hoạ....
Bài 4 trang 130 Hóa học 12: Đề xuất phương án phân biệt các dung dịch không màu CaCl2, BaCl2, KCl, NaCl và Na2CO3....
Xem thêm các bài giải bài tập Hóa Học lớp 12 Cánh diều hay, chi tiết khác:
Bài 17. Nguyên tố nhóm IA
Bài 18. Nguyên tố nhóm IIA
Bài 19. Nước cứng và làm mềm nước cứng
Bài 20. Sơ lược về kim lại chuyển tiếp dãy thứ nhất
Bài 21. Sơ lược về phức chất
Bài 22. Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch
