Lời giải bài tập Hóa học lớp 12 Bài 19: Nước cứng và làm mềm nước cứng sách Cánh diều hay, chi tiết sẽ giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập môn Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 19: Nước cứng và làm mềm nước cứng
Theo em, làm thế nào để làm giảm nồng độ các cation Ca2+ và Mg2+ trong nguồn nước trước khi sử dụng? Giải thích.
Hình 19.1. Một đoạn ống nước bị đóng cặn
Lời giải:
Để làm giảm nồng độ các cation Ca2+ và Mg2+ trong nguồn nước trước khi sử dụng ta có thể dùng phương pháp:
- Phương pháp tạo kết tủa:
+ Có thể cho vào nước dung dịch soda (Na2CO3) hoặc nước vôi trong (Ca(OH)2) để tạo kết tủa CaCO3, MgCO3. Sau đó lọc bỏ kết tủa.
MgSO4(aq) + Na2CO3(aq) ⟶ Na2SO4(aq) + MgCO3(s)
Ca(HCO3)2(aq) + Ca(OH)2(aq) ⟶ 2CaCO3(s) + 2H2O(l)
+ Đun sôi nước, sau đó lọc bỏ kết tủa.
Mg(HCO3)2(aq) MgCO3(s) + CO2(g) + H2O(l)
Ca(HCO3)2(aq) CaCO3(s) + CO2(g) + H2O(l)
- Phương pháp trao đổi ion: Cho nước chứa các cation Ca2+ và Mg2+đi qua lớp vật liệu hay màng vật liệu trao đổi ion.
Câu hỏi trang 131 Hóa học 12: Một loại nước có chứa nhiều CaCl2, Ca(HCO3)2, MgSO4 có tính cứng nào.
Lời giải:
Ta có:
Tính cứng tạm thời là tính cứng gây nên bởi các muối Ca(HCO3)2 và Mg(HCO3)2.
Tính cứng vĩnh cửu là tính cứng gây nên bởi các muối sulfate, chloride của calcium và magnesium.
Tính cứng toàn phần gồm tính cứng tạm thời và tính cứng vĩnh cửu.
Như vậy, loại nước có chứa nhiều CaCl2, Ca(HCO3)2, MgSO4 thì CaCl2, MgSO4 gây lên tính cứng vĩnh cửu còn Ca(HCO3)2 gây tính cứng tạm thời.
Vậy loại nước có chứa nhiều CaCl2, Ca(HCO3)2, MgSO4 có tính cứng toàn phần.
Lời giải:
Hiện tượng tắc ống dẫn nước khi sử dụng nước cứng có chứa Mg(HCO3)2 là do xuất hiện kết tủa MgCO3 theo phương trình hóa học:
Mg(HCO3)2(aq) ⟶ Mg2+(aq) + 2(aq)
Mg2+(aq) + (aq) + OH−(aq) ⟶ MgCO3(s) + H2O(l)
Hình ảnh bộ phận làm nóng của máy giặt sau khi tiếp xúc với nước cứng trong một thời gian dài
Em hãy đề xuất cách kiểm tra nguồn nước đang được sử dụng tại gia đình hoặc địa phương của em có phải nước cứng hay không. Nếu nước có tính cứng, hãy đưa ra biện pháp phù hợp để làm mềm nước.
Lời giải:
- Cách kiểm tra nguồn nước đang được sử dụng tại gia đình hoặc địa phương có phải nước cứng:
+ Đun nóng nước, nếu xuất hiện cặn trắng dưới đáy thì nước đó là nước cứng.
+ Thêm một ít dung dịch Ca(OH)2 trong vào bát nước, nếu xuất hiện vẩn đục trắng thì nước đó là nước cứng.
- Biện pháp làm mềm nước: Dùng Na2CO3, Na3PO4, Ca(OH)2 hoặc các vật liệu trao đổi ion để loại bỏ các cation Ca2+ và Mg2+ra khỏi nước.
Lời giải:
Dung dịch soda (Na2CO3)
Phương trình hoá học của phản ứng xảy:
CaSO4(aq) + Na2CO3(aq) ⟶ CaCO3(s) + Na2SO4(aq)
Bài tập
Bài 1 trang 134 Hóa học 12: Mỗi phát biểu dưới đây đúng hay sai?
(1) Nước cứng là nước chứa nhiều cation Ca2+ và Mg2+.
(2) Nước chứa ít hoặc không chứa các cation Ca2+ và Mg2+ được gọi là nước mềm.
(3) Soda, nước vôi trong, sodium phosphate có tác dụng làm mềm nước cứng.
(4) Phương pháp trao đổi ion làm giảm được cả tính cứng tạm thời và tính cứng vĩnh cửu của nước.
(5) Sự đóng cặn calcium carbonate trong dụng cụ đun nước hay trong đường ống dẫn nước là một dấu hiệu của việc sử dụng nước cứng.
Lời giải:
(1) Nước cứng là nước chứa nhiều cation Ca2+ và Mg2+. ⇒ Đúng.
(2) Nước chứa ít hoặc không chứa các cation Ca2+ và Mg2+ được gọi là nước mềm. ⇒ Đúng.
(3) Soda, nước vôi trong, sodium phosphate có tác dụng làm mềm nước cứng. ⇒ Sai.
Vì: Nước vôi trong Ca(OH)2 làm mất tính cứng tạm thời của nước; không làm mất tính cứng vĩnh cửu của nước.
(4) Phương pháp trao đổi ion làm giảm được cả tính cứng tạm thời và tính cứng vĩnh cửu của nước. ⇒ Đúng.
(5) Sự đóng cặn calcium carbonate trong dụng cụ đun nước hay trong đường ống dẫn nước là một dấu hiệu của việc sử dụng nước cứng. ⇒ Đúng.
Lời giải:
Sử dụng lượng soda phù hợp có thể làm mất tính cứng toàn phần của nước.
Vì nước cứng toàn phần chứa các chất như: Ca(HCO3)2, Mg(HCO3)2, MgSO4, CaSO4, MgCl2, CaCl2. Mà soda (Na2CO3) có thể tạo kết tủa với các cation Ca2+ và Mg2+ để loại bỏ các cation này ra khỏi nước theo phương trình hóa học:
Ca2+(aq) + (aq) ⟶ CaCO3(s)
Mg2+(aq) + (aq) ⟶ MgCO3(s)
a) Đề xuất thí nghiệm để kiểm chứng dự đoán của Hà.
b) Nếu lớp cặn là calcium carbonate, hãy:
• Đề xuất cách tiến hành để loại bớt cation Ca2+ có trong nguồn nước sinh hoạt của nhà bạn Hà trước khi nấu.
• Đề xuất cách tiến hành để làm sạch lớp cặn calcium carbonate ở đáy của ấm đun nước.
Lời giải:
a) Để kiểm chứng xem lớp cặn màu trắng đó có phải là calcium carbonate (CaCO3) ta dùng thí nghiệm sau:
- Lấy một ít cặn trắng đó cho vào cốc thủy tinh. Sau đó cho thêm một lượng giấm ăn (CH3COOH) vào rồi lắc đều.
- Nếu thấy lớp cặn tan và có sủi bọt khí làm tắt que đóm đang cháy thì lớp cặn trắng đó có calcium carbonate.
CaCO3(s) + 2CH3COOH(aq) ⟶ (CH3COO)2Ca(aq) + CO2(g) + H2O(l)
b)
• Cách tiến hành để loại bớt cation Ca2+ có trong nguồn nước sinh hoạt của nhà bạn Hà trước khi nấu:
+ Dùng một lượng soda vừa đủ.
+ Dùng máy lọc nước có vật liệu trao đổi ion.
• Cách tiến hành để làm sạch lớp cặn calcium carbonate ở đáy của ấm đun nước.
+ Sử dụng chanh hoặc giấm: Đổ nước vào ấm sau đó cho vào vài lát chanh tươi hoặc vài thìa giấm. Đun sôi, để nguội sau đó rửa bằng nước sạch.
Bài 4 trang 134 Hóa học 12: Hoàn thành các phương trình hoá học dưới đây:
a) MgSO4(aq) + Na3PO4(aq) ⟶ ?
b) MgSO4(aq) + Ca(OH)2(aq) ⟶ ?
c) Ca(HCO3)2(aq)
d) Ca(OH)2(aq) + HCl(aq) ⟶ ?
Cho biết phản ứng nào có thể được sử dụng để làm mềm nước cứng.
Lời giải:
a) 3MgSO4(aq) + 2Na3PO4(aq) ⟶ Mg3(PO4)2(s) + 3Na2SO4
b) MgSO4(aq) + Ca(OH)2(aq) ⟶ Mg(OH)2(s) + CaSO4(s)
c) Ca(HCO3)2(aq) CaCO3(s) + H2O(l) + CO2(g)
d) Ca(OH)2(aq) + 2HCl(aq) ⟶ CaCl2(aq) + 2H2O(l)
Phản ứng a và c được sử dụng để làm mềm nước cứng vì làm giảm nồng độ của các cation Ca2+ và Mg2+ trong nước bằng cách tạo kết tủa.
Phản ứng b mặc dù cũng tạo kết tủa với cation Mg2+, tuy nhiên CaSO4 là chất ít tan, vẫn tan một phần trong nước là tăng nồng độ cation Ca2+ trong nước.
Lý thuyết Lý thuyết Nước cứng và làm mềm nước cứng
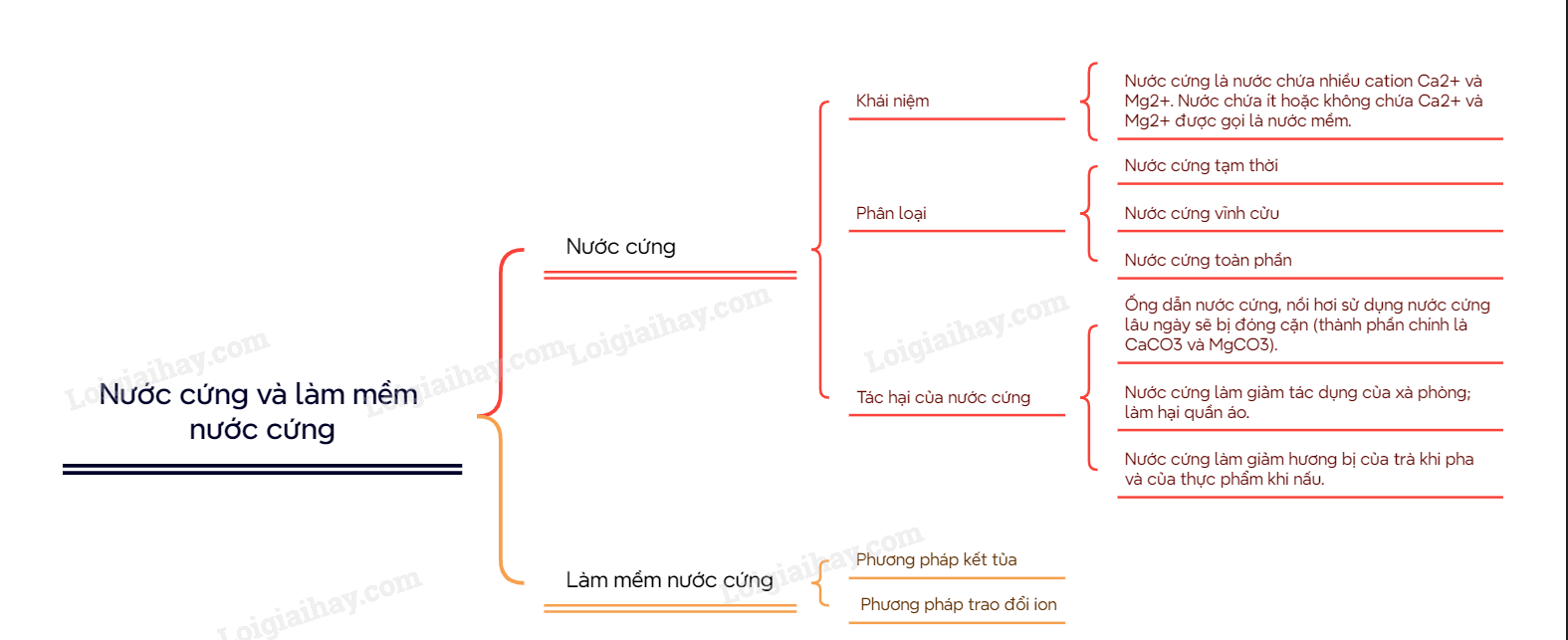
I. Nước cứng
1. Khái niệm
Nước cứng là nước chứa nhiều cation Ca2+ và Mg2+. Nước chứa ít hoặc không chứa Ca2+ và Mg2+ được gọi là nước mềm.
2. Phân loại
Căn cứ vào thành phần anion gốc aicd trong nước, nước cứng được chia thành ba loại:
- Nước cứng tạm thời được gây nên bởi các muối Ca(HCO3)2 và Mg(HCO3)2
- Nước cứng vĩnh cửu được gây nên bởi các muối sulfate, chloride của calcium và magnesium.
- Nước cứng toàn phần bao gồm nước cứng tạm thời và nước cứng vĩnh cửu.
3. Tác hại của nước cứng
Nước cứng gây nhiều tác hại trong đời sống và sản xuất
+ Ống dẫn nước cứng, nồi hơi sử dụng nước cứng lâu ngày sẽ bị đóng cặn (thành phần chính là CaCO3 và MgCO3). Lớp cặn này làm giảm lưu lượng nước trong ống dẫn, làm hỏng thiết bị, làm tiêu hao thêm nhiên liệu khi đun nóng nồi hơi, thậm chí có thể gây nổ nồi hơi.
+ Nước cứng làm giảm tác dụng của xà phòng; làm hại quần áo.
+ Nước cứng làm giảm hương bị của trà khi pha và của thực phẩm khi nấu.
II. Làm mềm nước cứng
1. Phương pháp kết tủa
Cơ sở của phương pháp này là chuyển cation Ca2+, Mg2+ trong nước về dạng chất không tan, có thể dễ dàng tách ra khỏi nước bằng cách lắng, lọc.
+ Khi đun sôi nước cứng, muối Ca(HCO3)2 và Mg(HCO3)2 bị phân hủy tạo ra muối không tan, làm mất tính cứng tạm thời của nước.
+ Dùng Ca(OH)2 với lượng vừa đủ để phản ứng với muối Ca(HCO3)2 và Mg(HCO3)2 tạo ra hợp chất không tan, làm mất tính cứng tạm thời của nước.
+ Dùng Na2CO3 hoặc Na3PO4 để làm mất tính cứng tạm thời và tính cứng vĩnh cửa của nước.
2. Phương pháp trao đổi ion
- Thực hiện bằng cách cho nước cứng đi qua lớp vật liệu hay màng vật liệu trao đổi ion. Các vật liệu này có chứa cation kim loại như Na+. Khi cho nước cứng đi qua vật liệu, các cation Ca2+ và Mg2+ đẩy cation Na+ ra khỏi vật liệu. Các cation Ca2+, Mg2+ bị giữ lại trên vật liệu.
- Phương pháp trao đổi ion làm giảm được cả tính cứng tạm thời và tính cứng vĩnh cửu.
Sơ đồ tư duy Nước cứng và làm mềm nước cứng
Xem thêm các bài giải bài tập Hóa Học lớp 12 Cánh diều hay, chi tiết khác:
Bài 19. Nước cứng và làm mềm nước cứng
Bài 20. Sơ lược về kim lại chuyển tiếp dãy thứ nhất
Bài 22. Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch