Với giải sách bài tập Hóa học 12 Bài 18: Nguyên tố nhóm IIA sách Cánh diều hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 12. Mời các bạn đón xem:
Sách bài tập Hóa học 12 Bài 18: Nguyên tố nhóm IIA
Bài 18.1 trang 58 Sách bài tập Hóa học 12: Nguyên tố nhóm IIA được tìm thấy trong tự nhiên dưới dạng nào?
(1) Các cation M2+ trong nước ao hồ, nước ngầm.
(2) Các khoáng vật ít tan như carbonate, sulfate, silicate.
(3) Các hợp chất ít tan trong răng, xương động vật.
A. (1) và (2).
B. (1) và (3).
C. (1), (2) và (3).
D. (2) và (3).
Lời giải:
Đáp án đúng là: C
Nguyên tố nhóm IIA được tìm thấy trong tự nhiên dưới dạng:
(1) Các cation M2+ trong nước ao hồ, nước ngầm.
(2) Các khoáng vật ít tan như carbonate, sulfate, silicate.
(3) Các hợp chất ít tan trong răng, xương động vật.
Bài 18.2 trang 58 Sách bài tập Hóa học 12: Những phát biểu nào sau đây là đúng?
(a) Số oxi hóa của các nguyên tố kim loại nhóm IIA trong hợp chất là +1 hoặc +2.
(b) Beryllium là kim loại nhẹ nhất trong các kim loại nhóm IIA.
(c) Magnesium là kim loại có nhiệt độ nóng chảy thấp nhất trong nhóm IIA.
(d) Các kim loại nhóm IIA đều có cấu trúc mạng tinh thể lập phương tâm khối.
(e) Các kim loại nhóm IIA đều dẫn điện.
Lời giải:
Các phát biểu đúng là: c, e
(a) Sai vì số oxi hóa của các nguyên tố nhóm IIA trong hợp chất chỉ là +2.
(b) Sai vì Ca là kim loại nhẹ nhất trong nhóm IIA.
(c) Đúng.
(d) Sai vì các kim loại nhóm IIA không có cùng một kiểu mạng tinh thể.
(e) Đúng.
Bài 18.3 trang 59 Sách bài tập Hóa học 12: Dãy các kim loại nào sau đây tác dụng nhanh với nước ở điều kiện thường?
A. Be, Na, Ba.
B. Mg, Ca, Ba.
C. Li, Ca, Ba.
D. Sr, Sn, Ba.
Lời giải:
Đáp án đúng là: C
Các kim loại: Li, Ca, Ba tác dụng nhanh với nước ở điều kiện thường.
Bài 18.4 trang 59 Sách bài tập Hóa học 12: Barium phản ứng với nước dễ dàng hơn so với magnesium ở điều kiện thường là do các nguyên nhân nào sau đây?
(1) Barium có tính khử mạnh hơn magnesium.
(2) Độ tan của barium hydroxide trong nước cao hơn nhiều so với magnesium hydroxide.
(3) Bọt khí hydrogen sinh ra bám trên bề mặt magnesium nhiều hơn, cản trở phản ứng tiếp diễn.
A. (1).
B. (1), (2) và (3).
C. (1) và (3).
D. (1) và (2).
Lời giải:
Đáp án đúng là: D
Barium phản ứng với nước dễ dàng hơn so với magnesium ở điều kiện thường là do:
(1) Barium có tính khử mạnh hơn magnesium.
(2) Độ tan của barium hydroxide trong nước cao hơn nhiều so với magnesium hydroxide.
Bài 18.5 trang 59 Sách bài tập Hóa học 12: Thực hiện phản ứng giữa các dung dịch sau:
(a) Potasium carbonate và calcium hydroxide.
(b) Sodium phosphate và barium chloride.
(c) Magnesium hydrogencarbonate và sulfuric acid.
(d) Sodium hydrogencarbonate và barium hydroxide.
(e) Barium hydroxide và nitric acid.
Những phản ứng nào thu được kết tủa? Viết phương trình hóa học của các phản ứng xảy ra.
Lời giải:
Phương trình hóa học:
(a) K2CO3 (aq)+ Ca(OH)2 (aq) → 2KOH (aq) + CaCO3 (s)
(b) 2Na3PO4 (aq) + 3BaCl2 (aq) → 6NaCl (aq) + Ba3(PO4)2 (s)
(c) Mg(HCO3)2 (aq) + H2SO4 (aq) → MgSO4 (aq) + 2H2O (l) + 2CO2 (g)
(d) NaHCO3 (aq) + Ba(OH)2 (aq) → NaOH (aq) + BaCO3 (s) + H2O (l)
(e) Ba(OH)2 (aq) + 2HNO3 (aq) → Ba(NO3)2 (aq) + 2H2O (l)
Các trường hợp a) b) d) thu được kết tủa.
Bài 18.6 trang 59 Sách bài tập Hóa học 12: Những phát biểu nào sau đây về ứng dụng của một số hợp chất của calcium là đúng?
(a) Vôi tôi và vôi sống đều có thể dùng để khử chua đất trong nông nghiệp.
(b) Đá vôi và thạch cao đều được dùng trong sản xuất vật liệu xây dựng.
(c) Khoáng vật apatite được khai thác để sản xuất phân đạm.
(d) Vôi tôi có thể được dùng để làm mềm nước cứng.
(e) Thạch cao còn được dùng trong y tế như bó bột cố định xương.
Lời giải:
Các phát biểu (a), (b), (d), (e) đúng.
Phát biểu (c) sai vì apatite dùng để sản xuất phân lân.
Bài 18.7 trang 60 Sách bài tập Hóa học 12: Tìm hiểu và cho biết vai trò của calcium đối với cơ thể người và các vấn đề sức khỏe có thể mắc phải khi thiếu hụt calcium. Liệt kê một số thực phẩm phù hợp để cung cấp calcium cho cơ thể.
Lời giải:
1. Vai trò của calcium với cơ thể người:
- Một số hợp chất không tan của calcium cấu tạo nên xương và răng, giúp phát triển, ổn định xương và răng.
- Một số hợp chất tan của calcium giúp ổn định chức năng truyền dẫn tín hiệu thần kinh đến tế bào, chức năng co giãn của cơ bắp (bao gồm cả cơ tim)
2. Các vẫn đề sức khỏe có thể mắc phải khi thiếu hụt calcium:
- Thiếu calcium gây các vấn đề về cơ: Một người bị thiếu calcium có thể gặp các vấn đề như co thắt, đau nhức cơ với các biểu hiện như: đau đùi khi đi bộ hoặc di chuyển, cảm giác tê bì ở cánh tay, bàn tay, bàn chân…
- Cảm giác mệt mỏi: Thiếu calcium có thể dẫn đến cảm giác kiệt sức và mệt mỏi. Bạn có thể gặp phải các triệu chứng uể oải và thiếu năng lượng trầm trọng, choáng váng, chóng mặt và sương mù não đặc trưng bởi thiếu tập trung, hay quên và lú lẫn... Sự thiếu hụt này cũng có thể dẫn đến mất ngủ.
- Tác động đến da và tóc: Calcium là một chất dinh dưỡng quan trọng cho tóc và da. Nếu không có đủ chất dinh dưỡng này có thể dẫn đến da khô, tóc khô, móng tay dễ gãy… Các rối loạn tự miễn dịch mãn tính như eczema và bệnh vẩy nến cũng có thể khởi phát do thiếu hụt calcium .
- Phát triển loãng xương: Xương cần hàm lượng calcium rất cao để duy trì sự chắc khỏe. Thiếu calcium gây giảm mật độ khoáng xương, dẫn đến loãng xương. Thiếu calcium tổng thể có thể làm cho xương giòn và dễ bị gãy.
- Hội chứng tiền kinh nguyệt nghiêm trọng (PMS): Mức độ calcium trong cơ thể thấp hơn cũng có liên quan đến hội chứng tiền kinh nguyệt (PMS).
Các nhà nghiên cứu đã xác nhận rằng nếu một người có mức calcium và vitamin D thấp trong nửa sau của chu kỳ kinh nguyệt, có thể có các triệu chứng của PMS tăng cao.
- Vấn đề nha khoa: Khi cơ thể thiếu calcium, sẽ làm ảnh hưởng tới sức khỏe của răng, có thể dẫn đến nhiều vấn đề răng miệng như: sâu răng, chân răng yếu...
- Trầm cảm: Một số nghiên cứu cho rằng sự thiếu hụt calcium có liên quan đến rối loạn tâm trạng, bao gồm cả trầm cảm. Tuy nhiên không có đủ bằng chứng liên quan đến điều này, nhưng các chuyên gia cho rằng có thể cả hai tình trạng này có liên quan đến nhau.
3. Một số thực phẩm phù hợp để cung cấp calcium cho cơ thể: sữa, ngũ cốc, các loại hạt rau cải, hải sản…
Bài 18.8 trang 60 Sách bài tập Hóa học 12: Một học sinh thực hiện các thí nghiệm để nhận biết hai dung dịch chất X và chất Y, thu được một số kết quả như sau:
- Dung dịch chất X và chất Y đều làm dung dịch phenolphtalein chuyển sang màu hồng.
- Trộn X và Y thu được kết tủa trắng.
- Chất X cháy với ngọn lửa màu lục trên đèn khí, trong khi chất Y cháy với ngọn lửa màu tím.
Mỗi kết luận sau đây của học sinh đó về chất X và chất Y là đúng hay sai? Biết mỗi chất X. Y đều chỉ chứa một loại cation và một loại anion.
(a) Chất X có chứa cation Ba2+, chất Y chứa cation K+.
(b) Chất X không thể là barium chloride.
(c) Chất Y phải là potassium carbonate.
(d) Chất kết tủa màu trắng phải là hợp chất của barium.
Lời giải:
(a) Đúng vì X cháy cho ngọn lửa màu lục, Y cháy cho ngọn lửa màu tím.
(b) Đúng vì X chuyển phenolphtalein sang màu hồng.
(c) Sai, Y có thể là KHCO3, K2SO3, K3PO4…
(d) Đúng vì các hợp chất của K (Y) tan trong nước.
Bài 18.9 trang 60 Sách bài tập Hóa học 12: Nhiệt độ phân hủy thành oxide của các muối carbonate của kim loại nhóm IIA giảm dần theo dãy:
A. MgCO3, CaCO3, SrCO3, BaCO3.
B. BaCO3, SrCO3, CaCO3, MgCO3.
C. BaCO3, CaCO3, SrCO3, MgCO3.
D. MgCO3, BaCO3, SrCO3, CaCO3.
Lời giải:
Đáp án đúng là: B
Do độ bền nhiệt của các muối carbonate giảm dần từ BaCO3 tới MgCO3.
Bài 18.10 trang 60 Sách bài tập Hóa học 12: Xét các phản ứng phân hủy sau:
CaCO3 (s)⇌ CaO (s) + CO2 (g) (1)
BaCO3 (s)⇌ BaO (s) + CO2 (g) (2)
Biến thiên enthalpy chuẩn () của phản ứng thuận ở mỗi cân bằng (1) và (2) khi phân hủy 1 mol mỗi chất lần lượt có giá trị là 108,7 kJ và 271,5 kJ.
Những phát biểu nào sau đây là đúng?
(a) Nhiệt lượng tỏa ra khi phân hủy 1 mol BaCO3 lớn hơn nhiệt lượng tỏa ra khi phân hủy 1 mol CaCO3.
(b) BaCO3 bị phân hủy ở nhiệt độ cao hơn CaCO3.
(c) Khi tăng nhiệt độ, cả hai phản ứng đều dịch chuyển theo chiều thuận.
(d) CO2 cần được lấy ra khỏi lò nung để tăng hiệu suất của phản ứng.
Lời giải:
Các phát biểu (b), (c), (d) đúng.
(a) Sai vì 2 phản ứng đều thu nhiệt.
(b) Đúng vì biến thiên enthalpy chuẩn của phản ứng (2) lớn hơn của phản ứng (1).
(c) Đúng vì 2 phản ứng đều thu nhiệt.
(d) Đúng vì giảm nồng độ CO2 thì cân bằng chuyển dịch theo chiều thuận.
Bài 18.11 trang 61 Sách bài tập Hóa học 12: Beryllium carbonate (BeCO3) khan là chất bột màu trắng, dễ phân hủy ngay trong điều kiện thường, tạo thành beryllium oxide. Do đó, BeCO3 thường được bảo quản trong khí quyển tạo bởi chất X. Giống như các muối carbonate của các kim loại nhóm IIA khác, BeCO3 ít tan trong nước; tuy nhiên, điểm khác biệt là chất này dễ bị thủy phân tạo thành các dạng tồn tại khác của beryllium như Điều này chủ yếu là do cation Be2+ có bán kính nhỏ hơn nhiều so với các cation kim loại cùng nhóm IIA. Việc thường xuyên hít phải BeCO3 hay BeO đều có thể dẫn tới ung thư phổi. Nếu đi vào cơ thể, các cation Be2+ có thể vô hiệu hóa chức năng của các enzyme, đặc biệt là các enzyme chứa phức chất có nguyên tử trung tâm được hình thành từ cation Mg2+.
Mỗi phát biểu sau đây là đúng hay sai?
(a) Phần trăm khối lượng của beryllium trong beryllium carbonate tinh khiết khan là 6,25%.
(b) Khí X là carbon dioxide.
(c) Mật độ điện tích của ion bằng điện tích của ion chia cho thể tích của ion đó. Ion được coi có dạng cầu nên thể tích của ion tỉ lệ với lũy thừa 3 của bán kính ion.
(c) Cation Be2+ dễ bị thủy phân hơn so với cation Ca2+ là do mật độ điện tích trên cation Be2+ nhỏ hơn so với cation Ca2+.
(d) Cation Be2+ có khả năng thay thế nguyên tử trung tâm magnesium của phức chất trong một số enzyme, tạo phức chất bền hơn.
Lời giải:
(a) Sai vì %Be= = 23,08 %
(b) Đúng.
Xét cân bằng: BeCO3(s) ⇌ BeO(s) + CO2(g), việc bảo quản BeCO3(s) trong khí CO2 là cân bằng chuyển dịch theo chiều nghịch, giúp làm giảm sự phân hủy BeCO3(s).
(c) Sai, Be2+ có bán kính nhỏ → thể tích nhỏ → mật độ điện tích lớn hơn so với Ca2+ nên dễ bị phân thủy phân hơn Be2+.
(d) Đúng.
Bài 18.12 trang 61 Sách bài tập Hóa học 12: a) Barium nitrate là hợp chất cộng hóa trị hay hợp chất ion, là chất dễ tan hay ít tan trong nước?
b) Hoàn thành các phương trình hóa học sau:
(1) Ba(NO3)2 (s)?
(2) Ba(NO3)2 (aq) + Na2SO4 (aq) → ?
c) Độ tan trong nước của Ba(NO3)2 ở 10 oC và 20 oC lần lượt là 6,67 g/100 g nước và 9,02 g/100 g nước. Khi đưa 109,02 g dung dịch Ba(NO3)2 bão hòa ở 20 oC về 10 oC thì thu được bao nhiêu gam tinh thể Ba(NO3)2.6H2O kết tinh?
d) Cho các hóa chất cơ bản sau: dung dịch NaOH, dung dịch HCl, dung dịch H2SO4, dung dịch NaCl. Hóa chất nào trong các hóa chất trên có thể được dùng để nhận biết được ion Ba2+ trong dung dịch barium nitrate? Viết phương trình hóa học minh họa.
Lời giải:
a) Barium nitrate là hợp chất ion, là chất dễ tan trong nước.
b) Hoàn thành các phương trình hóa học:
(1) 2Ba(NO3)2 (s) 2BaO (s) + 4NO2 (g) + O2 (g)
(2) Ba(NO3)2 (aq) + Na2SO4 (aq) → BaSO4 (s) + 2NaNO3 (aq)
c) Trong 109,02 g dung dịch Ba(NO3)2 bão hòa ở 20 oC có
⇒ = 9,02 g
⇒ mnước= 100 g
Gọi số mol Ba(NO3)2.6H2O kết tinh là a
⇒ Ở 10 oC,
→ a= 9,26.10-3
Vậy, khối lượng Ba(NO3)2.6H2O kết tinh là 369a= 3,42 g.
Bài 18.13 trang 62 Sách bài tập Hóa học 12: Gói làm nóng thức ăn (FRH: Flameless Ration Heater) được phát minh nhằm hâm nóng các bữa ăn tiện lợi cho người lính trên chiến trường. Một số gói lẩu tự sôi cũng sử dụng công nghệ này. FRH có thành phần chính gồm bột kim loại Mg trộn với một lượng nhỏ bột Fe và NaCl. Khi sử dụng, chỉ cần cho khoảng 30 mL nước vào hỗn hợp FRH, hỗn hợp này phản ứng mãnh liệt theo phương trình Mg + 2H2O → Mg(OH)2 + H2 và tỏa rất nhiều nhiệt, đủ để làm nóng thức ăn nhanh chóng.
a) Một gói FRH chứa khoảng 8 gam hỗn hợp (Mg 90%, Fe 4% và NaCl 4% về khối lượng) có thể tỏa ra tối đa bao nhiêu nhiệt để làm nóng? Biết rằng enthalpy tạo thành chuẩn () của Mg(OH)2 (s) và H2O (l) lần lượt là -928,4 kJ mol-1 và-285,8 kJ mol-1. Gói FRH trên có đủ làm nóng 300 g súp từ 30 oC lên 100 oC hay không? Biết nhiệt dung của súp khoảng 4,2 J g-1 C-1, giả sử gói súp chỉ nhận được 50% lượng nhiệt tối đa tỏa ra, phần nhiệt còn lại làm nóng các vật dụng khác và thất thoát vào môi trường.
b) Magnesium phản ứng chậm với nước ở nhiệt độ thường, giải thích vì sao magnesium trong gói FRH lại có thể phản ứng nhanh chóng với nước.
c) Vì sao người ta chỉ dùng khoảng 30 mL nước mà ko dùng lượng nước nhiều hơn?
Lời giải:
a) Mg (s) + 2H2O (l) → Mg(OH)2 (s) + H2 (g) (1)
nMg= = 0,3 mol → Q tỏa= 0,3.642,6 = 192,78 kJ
Để làm nóng 300 g súp từ 30 oC lên 100 oC:
Vì thất thoát nhiệt 50% nên thực tế Q cần = 88,2.2= 176,4 kJ
So sánh Q tỏa > Q cần nên gói FRH trên đủ làm nóng 300 g súp từ 30 oC lên 100 oC.
b) Magnesium phản ứng chậm với nước ở nhiệt độ thường do các bọt khí hydrogen bám trên bề mặt magnesium ngăn cản magnesium tiếp xúc với nước. Trong gói FRH, magnesium lại có thể phản ứng nhanh chóng với nước do có mặt Fe tạo thành pin Galvani (trong dung dịch chất điện li NaCl). Khi đó, hydrogen thoát ra trên bề mặt Fe nên diện tích tiếp xúc của Mg với nước tăng lên.
c) Nếu dùng lượng nước nhiều hơn 30 mL thì nhiệt tỏa ra cần cung cấp cho lượng nước dư nóng lên nên nhiệt độ của đồ ăn giảm đi, giảm hiệu quả đun nóng của gọi FRH.
Lý thuyết Nguyên tố nhóm IIA
I. Trạng thái tự nhiên
- Nhóm IIA gồm các nguyên tố: Be, Mg, Ca, Sr, Ba và Ra.
- Trong vỏ Trái Đất, các nguyên tố nhóm IIA chủ yếu tồn tại ở dạng muối carbonate, sulfate và silicate tạo nên nhiều loại khoáng vật ít tan.
- Trong nước mặt, nước ngầm,… các nguyên tố nhóm IIA tồn tạo ở dạng cation M2+ phổ biến nhất là Mg2+ và Ca2+
- Trong cơ thể, Mg và Ca tồn tại ở cả dạng hợp chất ít tan và dạng cation Mg2+, Ca2+
II. Đơn chất
1. Tính chất vật lí
- Bán kính nguyên tử và một số tính chất vật lí của kim loại nhóm IIA được thể hiện qua bảng sau:
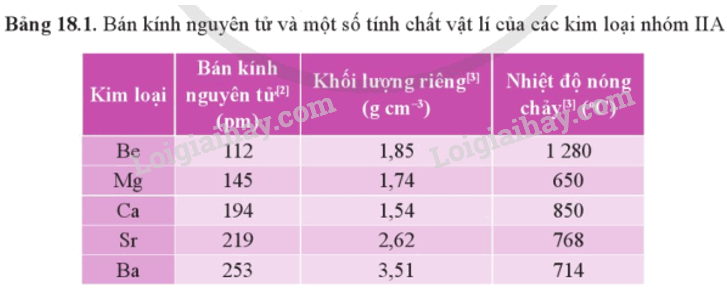
- Kim loại nhóm IIA thuộc nhóm kim loại nhẹ do có khối lượng riêng nhỏ. Chúng có nhiệt độ nóng chảy cao hơn so với kim loại nhóm IA, nhưng tương đối thấp so với các kim loại khác.
- Khác với kim loại kiềm, khối lượng riêng và nhiệt độ nóng chảy của kim loại nhóm IIA biến đổi không theo xu hướng rõ rệt.
2. Tính chất hóa học
a) Phản ứng với oxygen
Khi đốt nóng trong oxygen hoặc trong không khí, các kim loại nhóm IIA đều bốc cháy, tạo ra oxide theo phương trình hóa học tổng quát sau:
2M(s) + O2(g) 2MO(s)
Khi cháy, các kim loại nhóm IIA cho ngọn lửa có màu đặc trưng.
b) Phản ứng với nước
Be không tan trong nước, Mg phản ứng với nước rất chậm ở nhiệt độ thường, phản ứng mạnh hơn khi đun nóng. Ca, Sr, Ba phản ứng mạnh với nước ở nhiệt độ thường.
3. Ứng dụng
Ứng dụng cơ bản của một số kim loại nhóm IIA là tham gia tạo hợp kim.
III. Hợp chất của các nguyên tố nhóm IIA
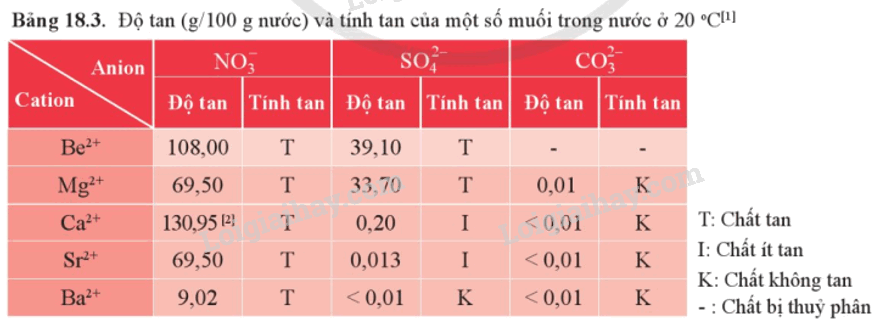
1. Độ tan của một số loại hợp chất
2. Một số loại muối phổ biến
a) Muối carbonate
- Muối carbonate của các nguyên tố Mg, Ca, Sr, Ba phản ứng với dung dịch acid, với nước có carbon dioxide hòa tan.
Ví dụ: CaCO3(s) + 2HCl(aq) CaCl2(aq) + H2O(l) + CO2(g)
CaCO3(s) + H2O(l) + CO2(aq) Ca(HCO3)2(aq)
- Các muối carbonate bị nhiệt phân, tạo thành oxide kim loại và khí carbon dioxide:
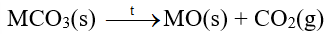
b) Muối nitrate
- Các muối nitrate của nguyên tố nhóm IIA bị nhiệt phân tạo oxide kim loại, khí nitrogen dioxide và oxygen.
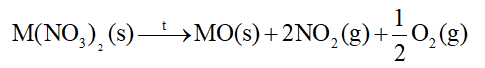
- Độ bền nhiệt của các muối nitrate có xu hướng tăng từ Mg(NO3)2 đến Ba(NO3)2.
3. Kiểm tra sự có mặt của ion trong dung dịch
Để nhận biết sự có mặt của mỗi ion Ca2+, Mg2+, CO32- hay SO42- trong dung dịch, người ta quan sát hiện tượng xảy ra như kết tủa, sủi bọt khí khi cho các chất phù hợp vào dung dịch.
4. Ứng dụng và vai trò của một số hợp chất của calcium
a) Ứng dụng của một số hợp chất của calcium có trong tự nhiên
thạch cao, apatite, đá vôi, vôi sống, vôi tôi có thành phần chính là các hợp chất của calcium. Chúng là nguyên liệu, vật liệu phổ biến và có nhiều ứng dụng trong đời sống, sản xuất.

b) Vai trò của hợp chất calcium trong cơ thể người
Trong cơ thể người:
+ Một số hợp chất không tan của calcium cấu tạo nên xương và răng, giúp phát triển, ổn định xương và răng.
+ Một số hợp chất tan của calcium giúp ổn định chức năng truyền dẫn tín hiệu thần kinh đến tế bào, chức năng co giãn của cơ bắp.
IV. Nhận biết kim loại và ion kim loại nhóm IIA
Khi đốt đơn chất hay hợp chất của Ca, Sr, Ba trên ngọn lửa khí thì ngọn lửa có màu khác nhau
+ Ca và hợp chất của Ca: ngọn lửa có màu đỏ cam.
+ Ba và hợp chất của Ba: ngọn lửa có màu lục.
Xem thêm các bài giải SBT Hóa học lớp 12 Cánh diều hay, chi tiết khác:
Bài 19: Nước cứng và làm mềm nước cứng
Bài 20: Sơ lược về kim lại chuyển tiếp dãy thứ nhất
Bài 22: Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch