Lời giải bài tập Hóa học lớp 12 Bài 21: Sơ lược về phức chất sách Cánh diều hay, chi tiết sẽ giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập môn Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 21: Sơ lược về phức chất
Phân tử [Ag(NH3)2]OH hoặc cation [Ag(NH3)2]+ đều được gọi là phức chất. Vậy phức chất là gì? Phức chất có cấu tạo như thế nào?
Lời giải:
Phức chất là phân tử hoặc ion trong đó có nguyên tử trung tâm liên kết với các phối tử bao quanh bởi liên kết cho nhận: phối tử cho cặp electron chưa liên kết vào orbital trống của nguyên tử trung tâm.
Phức chất có cấu tạo gồm: nguyên tử trung tâm và phối tử.
Lời giải:
Từ công thức Lewis của NH3, ta thấy phân tử NH3 còn một cặp electron chưa tham gia liên kết. Cặp electron chưa tham gia liên kết này có thể tạo liên kết cho nhận với orbital trống của nguyên tử trung tâm tạo phức chất.
Do đó phân tử NH3 có thể đóng vai trò là phối tử.
Câu hỏi trang 143 Hóa học 12: Hãy chỉ ra nguyên tử trung tâm và phối tử trong phức chất (3).
Lời giải:
Nguyên tử trung tâm là: Pt2+
Phối tử là: Cl− và NH3
a) Viết công thức của phức chất.
b) Vẽ dạng hình học của phức chất trên.
Lời giải:
a) Công thức của phức chất: [Cu(OH2)6]2+ hay [Cu(OH2)6]SO4
b) Dạng hình học của phức chất: [Cu(OH2)6]2+
Lời giải:
Bài tập
Bài 1 trang 145 Hóa học 12: Cho một phức chất có công thức [Fe(OH2)6](NO3)3.3H2O.
Chỉ ra nguyên tử trung tâm và phối tử của phức chất trên.
Lời giải:
Nguyên tử trung tâm là: Fe3+
Phối tử là: H2O
Bài 2 trang 145 Hóa học 12: Hãy chỉ ra liên kết cho – nhận trong phức chất [PtCl4]2-.
Lời giải:
Liên kết cho – nhận trong phức chất [PtC14]2- là: mỗi anion Cl- cho một cặp electron chưa liên kết vào orbital trống của cation Pt2+.
Bài 3 trang 145 Hóa học 12: Mỗi phát biểu dưới đây là đúng hay sai?
(1) Phức chất có thể mang điện tích hoặc không mang điện tích.
(2) Phức chất mà nguyên tử trung tâm tạo 4 liên kết ở với các phối tử luôn có dạng hình học là tứ diện.
(3) Giống như phân tử amionia (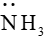
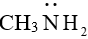
Lời giải:
(1) Phức chất có thể mang điện tích hoặc không mang điện tích. ⇒ Đúng.
(2) Phức chất mà nguyên tử trung tâm tạo 4 liên kết ở với các phối tử luôn có dạng hình học là tứ diện. ⇒ Sai vì ngoài dạng hình học là tứ diện còn có thể là dạng vuông phẳng.
(3) Giống như phân tử amionia (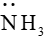
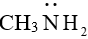
Lý thuyết Sơ lược về phức chất
I. Một số khái niệm
- Phức chất đơn giản thường có một nguyên tử trung tâm liên kết với các phối tử bằng liên kết cho nhận
- Liên kết giữa nguyên tử trung tâm và phối tử trong phức chất là liên kết cho – nhận: phối tử cho cặp electron chưa liên kết vào orbital trống của nguyên tử trung tâm
+ Phối tử là các phân tử hoặc anion đã cho cặp electron chưa liên kết
+ Nguyên tử trung tâm là cation kim loại hoặc nguyên tử kim loại có orbital trống đã nhận cặp electron chưa liên kết của phối tử.
II. Dạng hình học của phức chất
- Phức chất có nhiều dạng hình học khác nhau như vuông phẳng, tứ diện, bát diện,…
- Dạng hình học của phức chất được xác nhận bằng thực nghiệm
- Phức chất mà nguyên tử trung tâm tạo 6 liên kết σ với các phối tử thường có dạng hình học bát diện, được gọi là phức chất bát diện
Ví dụ: 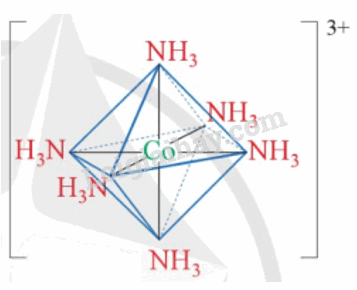
- Phức chất mà nguyên tử trung tâm tạo 4 liên kết σ với các phối tử thường có dạng hình học là tứ diện hoặc vuông phẳng, được gọi là phức chất tứ diện hoặc phức chất vuông phẳng.
Ví dụ: 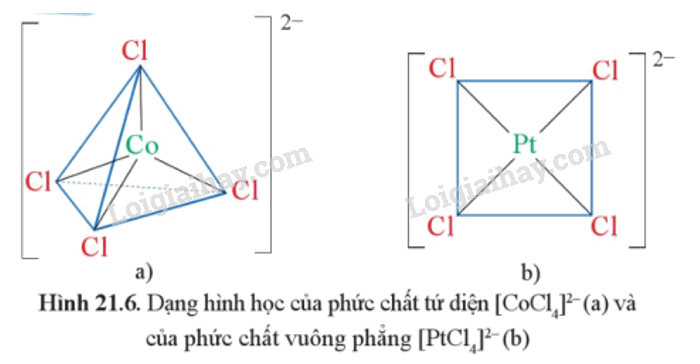
Sơ đồ tư duy Sơ lược về phức chất
Xem thêm các bài giải bài tập Hóa Học lớp 12 Cánh diều hay, chi tiết khác:
Bài 19. Nước cứng và làm mềm nước cứng
Bài 20. Sơ lược về kim lại chuyển tiếp dãy thứ nhất
Bài 22. Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch