Tailieumoi.vn xin giới thiệu Trắc nghiệm Hóa học lớp 11 Bài 6: Sulfur và sulfur dioxide sách Chân trời sáng tạo. Bài viết gồm 15 câu hỏi trắc nghiệm với đầy đủ các mức độ và có hướng dẫn giải chi tiết sẽ giúp học sinh ôn luyện kiến thức và rèn luyện kĩ năng làm bài trắc nghiệm Hóa học 11. Ngoài ra, bài viết còn có phần tóm tắt nội dung chính lý thuyết Bài 6: Sulfur và sulfur dioxide. Mời các bạn đón xem:
Trắc nghiệm Hóa học 11 Bài 6: Sulfur và sulfur dioxide
Phần 1. Trắc nghiệm Sulfur và sulfur dioxide
Câu 1: Cho phản ứng: SO2 + NO2 SO3 + NO. Trong phản ứng SO2 đóng vai trò là
A. chất bị khử.
B. chất bị oxi hóa.
C. môi trường.
D. vừa là chất khử vừa là chất oxi hoá.
Đáp án đúng là: B
Trong phản ứng SO2 đóng vai trò làchất khử (hay chất bị oxi hoá), do số oxi hoá của sulfur tăng từ +4 lên +6.
Câu 2: Cách xử lý thủy ngân khi nhiệt kế thủy ngân không may bị vỡ là
A. rắc bột sulfur lên thủy ngân rồi gom lại.
B. rắc muối ăn lên thủy ngân rồi gom lại.
C. rắc đường lên thủy ngân rồi gom lại.
D. rắc bột sắt lên thủy ngân rồi gom lại.
Đáp án đúng là: A
Cách xử lý thủy ngân khi nhiệt kế thủy ngân không may bị vỡ là rắc bột sulfur lên thủy ngân rồi gom lại.
Câu 3: Trong khí thải do đốt nhiên liệu hóa thạch có chất khí X không màu, mùi hắc, gây viêm đường hô hấp ở người. Khi khuếch tán vào bầu khí quyển, X là nguyên nhân chủ yếu gây hiện tượng “mưa acid’. X là
A. SO2.
B. CO2.
C. H2S.
D. CO.
Đáp án đúng là: A
Khí X là SO2.
Câu 4: Sulfur dioxide là chất khử trong phản ứng nào sau đây?
A. SO2 + NaOH NaHSO3.
B. SO2 + 2H2S 3S + 2H2O.
C. SO2 + NO2 SO3 + NO.
D. SO2 + 2KOH K2SO3 + H2O.
Đáp án đúng là: C
SO2 + NO2 SO3 + NO.
Trong phản ứng này, số oxi hoá của S tăng từ +4 đến +6 nên SO2 đóng vai trò là chất khử.
Câu 5: Cho sulfur lần lượt phản ứng với các chất sau ở điều kiện thích hợp: hydrogen, oxygen, mercury, aluminium, fluorine. Số phản ứng mà sulfur là chất oxi hóa là
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án đúng là: C
Trong phản ứng với hydrogen và kim loại (mercury, aluminium) thì sulfur đóng vai trò là chất oxi hoá.
Câu 6: Sulfur là chất rắn có màu
A. đỏ.
B. vàng.
C. không màu.
D. xanh.
Đáp án đúng là: B
Sulfur là chất rắn có màu vàng.
Câu 7: Chất phản ứng ngay với bột sulfur ở điều kiện thường là
A. H2.
B. O2.
C. Hg.
D. Fe.
Đáp án đúng là: C
Hg (thuỷ ngân, mercury) phản ứng với sulfur ở ngay điều kiện thường.
Hg + S → HgS
Câu 8: Hợp chất SO2 có tên gọi là
A. sulfur oxide.
B. sulfur dioxide.
C. disulfur oxide.
D. sulfur trioxide.
Đáp án đúng là: B
Hợp chất SO2 có tên gọi là sulfur dioxide.
Câu 9: Trong phản ứng: . Sulfur đóng vai trò là
A. chất khử.
B. chất oxi hóa.
C. chất bị khử.
D. kim loại.
Đáp án đúng là: A
Trong phản ứng: Sulfur đóng vai trò là chất khử, do số oxi hoá của sulfur tăng từ 0 lên +4.
Câu 10: Phản ứng nào sau đây sulfur đóng vai trò là chất khử?
A.
B.
C.
D.
Đáp án đúng là: A
Sulfur đóng vai trò là chất khử trong phản ứng:
Do trong phản ứng này, số oxi hoá của sulfur tăng từ 0 lên +4.
Câu 11: Cho hình vẽ mô tả thí nghiệm:
Hiện tượng xảy ra trong bình eclen (bình tam giác) chứa dung dịch nước Br2 là
A. có kết tủa xuất hiện.
B. dung dịch nước Br2 bị mất màu.
C. vừa có kết tủa vừa mất màu dung dịch nước Br2.
D. dung dịch nước Br2 không bị mất màu.
Đáp án đúng là: B
Dung dịch Br2 bị mất màu. Phương trình hoá học minh hoạ:
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
SO2 + Br2 + 2H2O → 2HBr + H2SO4
Câu 12: Tính chất vật lý nào sau đây không phải của sulfur dioxide?
A. Chất khí, không màu, mùi xốc, độc.
B. Chất khí, mùi xốc, không độc.
C. Chất khí, nặng hơn không khí.
D. Chất khí, tan nhiều trong nước.
Đáp án đúng là: B
Sulfur dioxide là chất khí, không màu, mùi xốc, độc.
Câu 13: Cho các phản ứng hóa học sau:
(1) SO2 + Br2 + 2H2O 2HBr + H2SO4
(2) SO2 + 2H2S 3S + 2H2O
(3) 5SO2 + 2KMnO4 + 2H2O 2MnSO4 + K2SO4 + 2H2SO4
(4) SO2 + 2Mg S + 2MgO
Có bao nhiêu phản ứng trong đó SO2 là chất oxi hóa?
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án đúng là: B
Trong phản ứng (2), (4) số oxi hoá của sulfur giảm từ +4 xuống 0 nên SO2 đóng vai trò là chất oxi hoá.
Câu 14: Hỗn hợp X gồm hai khí SO2 và CO2 có tỉ khối đối với H2 là 26. Thành phần % theo khối lượng của SO2 là
A. 50,77%.
B. 49,23%.
C. 40%.
D. 60%.
Đáp án đúng là: B
Gọi số mol của SO2 và CO2 lần lượt là a và b (mol)
Thành phần % theo khối lượng của SO2 là
Câu 15: Dẫn khí SO2 vào 100 mL dung dịch KMnO4 0,02M đến khi mất màu tím theo sơ đồ phản ứng:
Thể tích khí SO2 (đkc) đã phản ứng là
A. 50 mL.
B. 258 mL.
C. 124 mL.
D. 100 mL.
Đáp án đúng là: C
Thể tích khí SO2 (đkc) đã phản ứng là: 5.10-3.24,79 = 0,12395 lít = 123,95 mL.
Phần 2. Lý thuyết Sulfur và sulfur dioxide
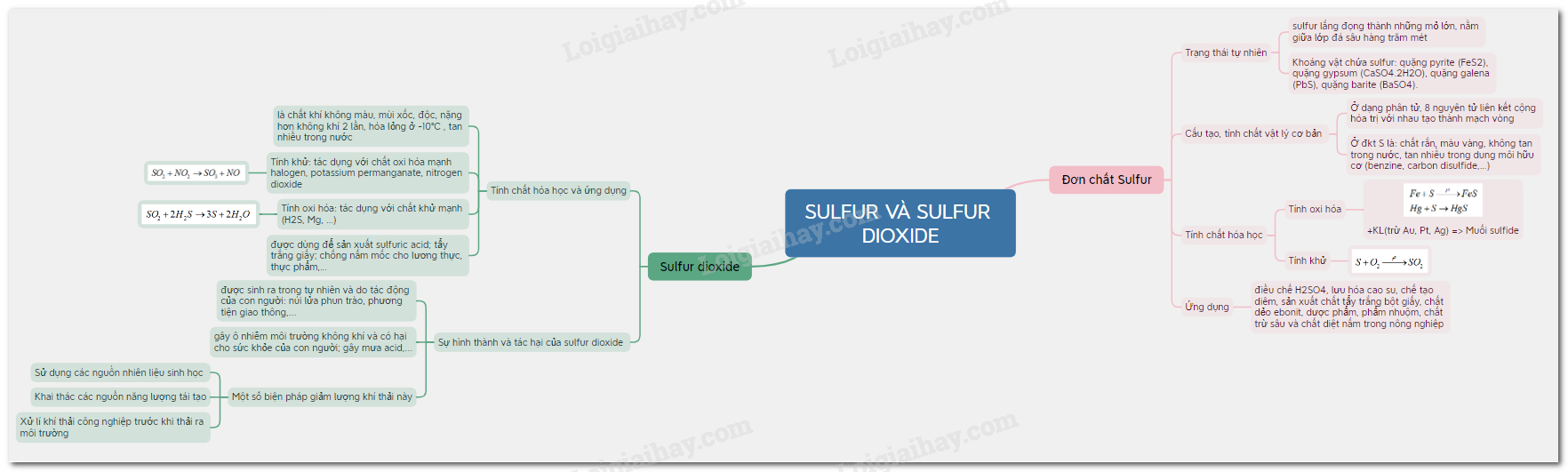
1. Đơn chất Sulfur
a) Trạng thái tự nhiên:
- Trong tự nhiên, sulfur lắng đọng thành những mỏ lớn, nằm giữa lớp đá sâu hàng trăm mét.
- Khoáng vật trong tự nhiên chứa sulfur ở dạng hợp chất: quặng pyrite (FeS2), quặng gypsum (CaSO4.2H2O), quặng galena (PbS), quặng barite (BaSO4).
b) Cấu tạo, tính chất vật lý cơ bản của sulfur đơn chất
- Ở dạng phân tử, 8 nguyên tử liên kết cộng hóa trị với nhau tạo thành mạch vòng. Kí hiệu là S.
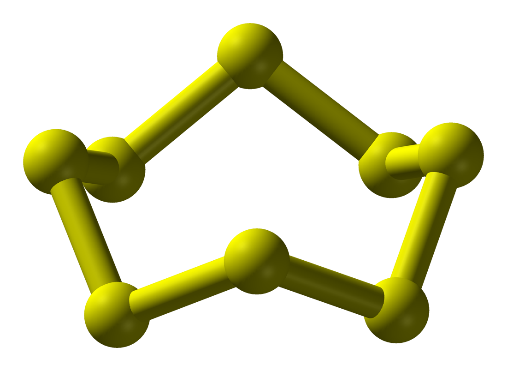
Hình 1: Phân tử sulfur ở điều kiện thường
-Ở điều kiện thường sulfur là: chất rắn, màu vàng, không tan trong nước, tan nhiều trong dung môi hữu cơ (benzine, carbon disulfide,…)
c) Tính chất hóa học
- Tính oxi hóa: sulfur oxi hóa được nhiều kim loại (trừ Au, Pt, Ag) ở nhiệt độ cao -> Muối sulfide
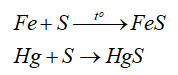
-Tính khử:
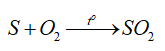
d) Ứng dụng
- Sulfur có nhiều ứng dụng như: điều chế H2SO4, lưu hóa cao su, chế tạo diêm, sản xuất chất tẩy trắng bột giấy, chất dẻo ebonit, dược phẩm, phẩm nhuộm, chất trừ sâu và chất diệt nấm trong nông nghiệp,…
2. Sulfur dioxide
a) Tính chất hóa học và ứng dụng
- SO2 là chất khí không màu, mùi xốc, độc, nặng hơn không khí 2 lần, hóa lỏng ở -10℃ , tan nhiều trong nước.
- Tính khử: SO2 là chất khử khi tác dụng với chất oxi hóa mạnh (halogen, potassium permanganate, nitrogen dioxide,…)
-Tính oxi hóa: SO2 là chất oxi hóa khi tác dụng với chất khử mạnh (H2S, Mg, …)
-Sulfur dioxide được dùng để sản xuất sulfuric acid; tẩy trắng giấy; chống nấm mốc cho lương thực, thực phẩm,…
b) Sự hình thành sulfur dioxide, tác hại của sulfur dioxide và một số biện pháp giảm thiểu lượng sulfur dioxide thải vào không khí
- Sulfur dioxide được sinh ra trong tự nhiên và do tác động của con người

-Sulfur dioxide là một trong các chất chủ yếu gây ô nhiễm môi trường không khí và có hại cho sức khỏe của con người; sự phát thải SO2 vào bầu khí quyển cũng là một trong những nguyên nhân gây mưa acid.
-Một số biện pháp giảm lượng khí thải này:
+ Sử dụng các nguồn nhiên liệu sinh học thân thiện với môi trường thay cho nguồn năng lượng hóa thạch.
+ Khai thác các nguồn năng lượng tái tạo như: năng lượng mặt trời, năng lượng gió, mưa, sóng biển,…
+ Xử lí khí thải công nghiệp trước khi thải ra môi trường.
Sơ đồ tư duy Sulfur và Sulfur dioxide
Xem thêm các bài Trắc nghiệm Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác: