Lời giải bài tập Hóa học lớp 12 Bài 16: Hợp kim – Sự ăn mòn kim loại sách Chân trời sáng tạo hay, chi tiết sẽ giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập môn Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 16: Hợp kim – Sự ăn mòn kim loại
Lời giải:
- Sự ăn mòn kim loại là sự phá huỷ kim loại hoặc hợp kim do tác dụng của các chất trong môi trường. Có hai loại ăn mòn chính: ăn mòn hoá học và ăn mòn điện hoá.
- Có hai phương pháp thường dùng để chống ăn mòn kim loại: phương pháp bảo vệ bề mặt và phương pháp điện hoá.
Câu hỏi 1 trang 85 Hóa học 12: Hãy kể tên một số hợp kim thường gặp trong cuộc sống.
Lời giải:
Các hợp kim thường gặp:
- Hợp kim của sắt như gang, thép, inox,…
- Hợp kim của nhôm như dural,…
Câu hỏi 2 trang 86 Hóa học 12: Nêu một số ví dụ về tính chất của hợp kim mà em biết.
Lời giải:
- Tính chất hóa học của hợp kim tương tự như tính chất hóa học của các đơn chất thành phần.
- Hợp kim còn có các tính chất khác hơn so với các đơn chất thành phần như bền dù ở nhiệt độ cao, ít bị ăn mòn; cứng hơn; độ dẫn điện, dẫn nhiệt của hợp kim thường kém hơn;...
Câu hỏi 3 trang 86 Hóa học 12: Hãy so sánh thành phần, tính chất và ứng dụng của gang và thép.
Phương pháp giải:
- Gang là hợp kim của Fe và C, trong đó C chiếm khoảng từ 2% - 5% về khối lượng. Trong gang có một lượng nhỏ các nguyên tố khác như: Si, S, Mn, P,...
- Thép là hợp kim của Fe và C, trong đó C chiếm dưới 2% về khối lượng. Trong thép còn có thể có một số nguyên tố khác như: Si, Mn, Cr, Ni,...
Lời giải:
|
|
Gang |
Thép |
|
Thành phần |
Hợp kim của Fe và C, trong đó C chiếm khoảng từ 2% - 5% về khối lượng, ngoài ra còn có một lượng nhỏ các nguyên tố khác. |
Hợp kim của Fe và C, trong đó C chiếm dưới 2% về khối lượng, ngoài ra còn có một lượng nhỏ các nguyên tố khác. |
|
Tính chất |
Gang cứng và giòn hơn sắt. |
Thép có tính đàn hồi, cứng, ít bị ăn mòn, … hơn sắt. |
|
Ứng dụng |
- Gang trắng: Luyện thép. - Gang xám: Đúc bệ máy, ông dẫn nước |
Chế tạo chi tiết mày, dụng cụ lao động, vật liệu xây dựng, phương tiện giao thông,… |
Lời giải:
- Các yếu tố gây nên sự ăn mòn kim loại: hơi nước, khí oxygen, acid có trong nước mưa, không khí ẩm, muối có trong nước biển,…
- Bản chất của quá trình ăn mòn là quá trình oxi hóa khử, trong đó kim loại là chất bị oxi hóa.
Phương pháp giải:
Trong phản ứng oxi hóa khử:
+ Chất khử có số oxi hóa tăng, chất oxi hóa có số oxi hóa giảm.
+ Chất khử thực hiện quá trình oxi hóa, chất oxi hóa thực hiện quá trình khử.
Lời giải:
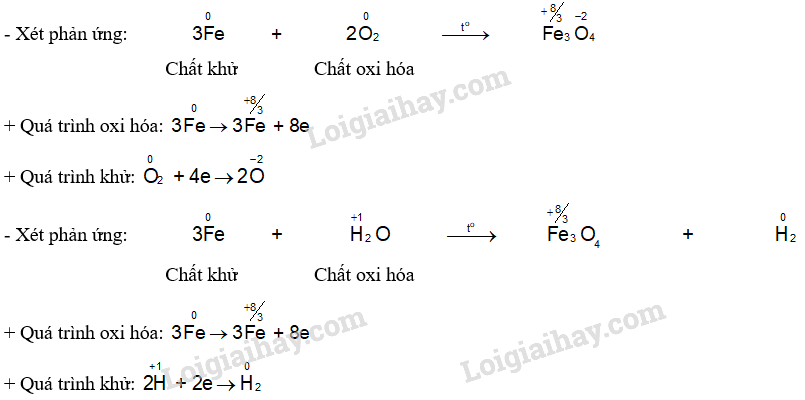
Lời giải:
- Khi chưa nối dây dẫn, thanh sắt bị hoà tan trong dung dịch H2SO4, xuất hiện bọt khí H2 thoát ra ở bề mặt thanh sắt.
- Khi nối dây dẫn giữa thanh sắt và thanh đồng, sắt bị ăn mòn nhanh hơn trong dung dịch H2SO4, xuất hiện bọt khí H2 thoát ra ở bề mặt thanh sắt và thanh đồng, đèn sáng.
Câu hỏi 7 trang 88 Hóa học 12: Xác định các quá trình oxi hoá, quá trình khử xảy ra ở Thí nghiệm 1.
Lời giải:
+ Quá trình oxi hóa:
+ Quá trình khử:
Lời giải:
- Sau một thời gian để trong không khí ẩm sợi đây bị đứt ở chỗ nối bên nhôm.
- Giải thích: ở vị trí nối hai kim loại, nhôm bị ăn mòn điện hóa. Khi nhôm và đồng tiếp xúc trực tiếp với nhau và cùng tiếp xúc với không khí ẩm, hiện tượng ăn mòn điện hóa xuất hiện.
+ Nhôm đóng vai trò là anode (-):
+ Đồng đóng vai trò là cathode (+):
Kết quả của hiện tượng này là nhôm bị ăn mòn ở vị trí tiếp xúc với đồng, làm sợi dây bị đứt.
Lời giải:
|
|
Hiện tượng |
Giải thích |
|
Cốc 1 |
Cây đinh bị gỉ. |
Cây đinh tiếp xúc với nước trong dung dịch và oxygen nên bị oxi hóa, tạo thành gỉ sắt. |
|
Cốc 2 |
Dây kẽm bị ăn mòn, cây đinh gần như không bị ăn mòn. |
Khi quấn kẽm vào đinh sắt rồi ngâm chúng trong dung dịch NaCl, xuất hiện hiện tượng ăn mòn điện hóa, kẽm có tính khử mạnh hơn sắt nên kẽm bị ăn mòn, do đó đinh sắt được bảo vệ. |
Lời giải:
Thành phần chính của thép là Fe, khi gắn Zn vào vỏ tàu sẽ tạo thành cặp điện cực Zn – Fe. Hai điện cực tiếp xúc trực tiếp với nhau và cùng tiếp xúc với dung dịch điện li (nước biển) nên xảy ra hiện tượng ăn mòn điện hóa. Trong đó, kẽm có tính khử mạnh hơn nên bị ăn mòn, do đó vỏ tàu được bảo vệ.
Bài tập
Bài 1 trang 90 Hóa học 12: Phân biệt ăn mòn hoá học và ăn mòn điện hoá.
Lời giải:
|
|
Ăn mòn hóa học |
Ăn mòn điện hóa |
|
Điều kiện xảy ra ăn mòn |
Thường xảy ra khi kim loại tiếp xúc với không khí, không khí ẩm. |
- Các điện cực phải khác nhau, có thể cặp hai kim loại khác nhau hoặc cặp kim loại – phi kim hoặc cặp kim loại – hợp chất hoá học. - Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn. - Các điện cực phải tiếp xúc với dung dịch điện li. |
|
Bản chất của sự ăn mòn |
Là quá trình oxi hóa - khử, trong đó các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường, ăn mòn xảy ra chậm. |
Là quá trình oxi hóa khử mà kim loại bị ăn mòn do tác dụng của dung dịch chất điện li và tạo nên dòng điện. Mòn điện hóa xảy ra nhanh hơn ăn mòn hóa học. |
Lời giải:
Gang, thép là hợp kim Fe – C và một số nguyên tố khác. Không khí ẩm có hoà tan khí CO2, O2,... tạo ra lớp dung dịch chất điện li phủ lên bề mặt gang, thép, làm xuất hiện vô số pin điện hoá mà Fe là cực âm, C là cực dương
– Ở cực âm xảy ra sự oxi hoá :
– Ở cực dương xảy ra sự khử :
Ion Fe2+ tan vào dung dịch chất điện li có hòa tan khí oxygen và tiếp tục bị oxi hóa tạo ra gỉ sắt có thành phần chủ yếu là Fe2O3.nH2O.
Lời giải:
- Khi để lâu vật này trong không khí ẩm thì xuất hiện gỉ sắt vì sắt bị ăn mòn điện hóa.
- Giải thích: hai kim loại Sn – Fe cùng không khí ẩm có hoà tan khí CO2, O2,... tạo ra lớp dung dịch chất điện li phủ lên bề mặt lớp sắt tây bị xây xát chạm tới sắt. Pin điện hóa xuất hiện với cực dương là Sn và cực âm là Fe.
+ Ở cực âm xảy ra sự oxi hoá :
+ Ở cực dương xảy ra sự khử :
Ion Fe2+ tan vào dung dịch chất điện li có hòa tan khí oxygen và tiếp tục bị oxi hóa tạo ra gỉ sắt có thành phần chủ yếu là Fe2O3.nH2O.
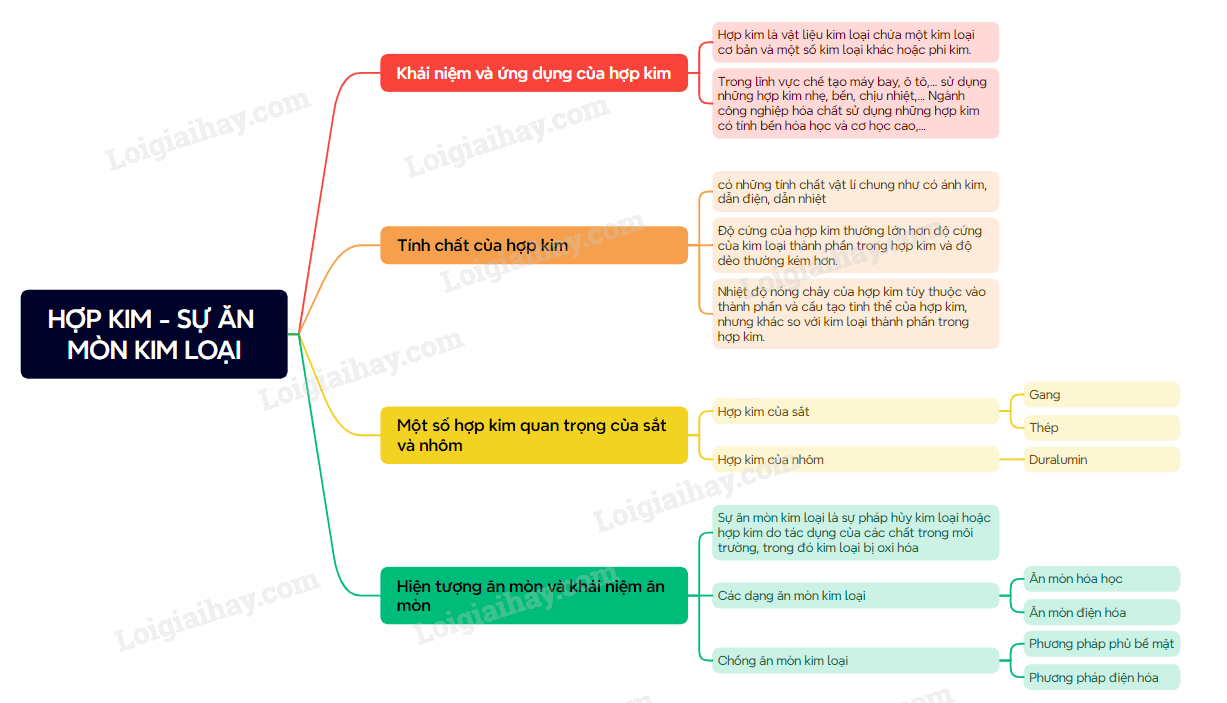
Lý thuyết Hợp kim – Sự ăn mòn kim loại
1. Hợp kim
- Hợp kim là vật liệu kim loại có chứa một kim loại cơ bản và một số kim loại khác hoặc phi kim. - Hợp kim có nhiều tính chất cơ học, tính chất vật lí vượt trội so với kim loại, ngày càng được sử dụng phổ biến trong các ngành kinh tế quốc dân
Tính chất của hợp kim
- Hợp kim có nhiều tính chất hóa học tương tự tính chất hóa học của các đơn chất thành phần, tuy nhiên tính chất vật lí và tính chất cơ học của hợp kim khác so với tính chất của các đơn chất thành phần.
Thành phần, tính chất và ứng dụng một số hợp kim quan trọng của sắt và nhôm
- Gang là hợp kim của Fe và C, trong đo C chiếm khoảng 2 – 5% về khối lượng. Trong gang có một lượng nhỏ các nguyên tố khác như: Si, S, Mn, P,…
- Thép là hợp kim của Fe và C, trong đó C chiếm dưới 2% về khối lượng. Trong thép còn có thể có một nguyên tố khác như: Si. Mn, Cr, Ni,…
- Hợp kim của nhôm quan trọng là dural với thành phần chính là Al, Cu và một số nguyên tố khác như Mg, Mn, Fe,… Hợp kim này có nhiều ưu điểm như bền, nhẹ trong không khí và nước nên được sử dụng làm vật liệu chế tạo máy bay, ô tô, tên lửa,…
2. Ăn mòn kim loại
- Sự ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kim do tác dụng của các chất trong môi trường.
a) Ăn mòn hóa học
Ăn mòn hóa học là quá trình oxi hóa – khử, trong đó các electron của kim loại chuyển trực tiếp đến các chất trong môi trường
b) Ăn mòn điện hóa
Ăn mòn điện hóa là quá trình ăn mòn kim loại do sự tạo thành pin điện hóa
Điều kiện xảy ra sự ăn mòn điện hóa
1. Có hai kim loại khác nhau hoặc kim loại với phi kim,…
2. Tiếp xúc trực tiếp với nhau hoặc gián tiếp qua dây dẫn điện
3. Cùng tiếp xúc với một dung dịch chất điện li
Thiếu một trong ba điều kiện trên sẽ không xảy ra sự ăn mòn điện hóa
3. Chống ăn mòn kim loại
a) Phương pháp phủ bề mặt
Phương pháp bảo vệ bề mặt là phủ lên bề mặt của kim loại một lớp sơn, dầu, mỡ, chất dẻo hoặc tráng, mạ bằng một kim loại khác
b) Phương pháp điện hóa
Trong phương pháp điện hóa, để bảo vệ kim loại, người ta nối kim loại cần bảo vệ với một kim loại hoạt động hóa học mạnh hơn
Sơ đồ tư duy Hợp kim - Sự ăn mòn kim loại
Xem thêm các bài giải bài tập Hóa Học lớp 12 Chân trời sáng tạo hay, chi tiết khác:
Bài 15. Các phương pháp tách kim loại
Bài 16. Hợp kim – Sự ăn mòn kim loại
Bài 19. Đại cương về kim loại chuyển tiếp dãy thứ nhất
Bài 20. Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch