Lời giải bài tập Hóa học lớp 12 Bài 19: Đại cương về kim loại chuyển tiếp dãy thứ nhất sách Chân trời sáng tạo hay, chi tiết sẽ giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập môn Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 19: Đại cương về kim loại chuyển tiếp dãy thứ nhất
Lời giải:
- Cấu hình electron nguyên tử của các nguyên tố kim loại chuyển tiếp dãy thứ nhất có dạng [Ar]3d1÷10 4s1÷2.
- Tính chất vật lí: Các kim loại chuyển tiếp dãy thứ nhất có nhiệt độ nóng chảy, khối lượng riêng, độ cứng cao hơn kim loại nhóm IA và nhóm IIA trong cùng chu kì.
- Ứng dụng:
+ Đồng được dùng trong sản xuất các thiết bị như: biến thế, cầu dao điện, dây dẫn điện,...
+ Chromium được dùng mạ lên các thiết bị để chống mài mòn, chế tạo hợp kim đặc biệt.
+ Scandium, titanium được dùng để chế tạo hợp kim ứng dụng trong hàng không, vũ trụ.
+ Vanadium được dùng trong chế tạo thiết bị chịu nhiệt.
+ Sắt, manganese được dùng trong sản xuất thiết bị quốc phòng, công nghiệp, nông nghiệp, đời sống.
+ Sắt, cobalt được dùng để chế tạo nam châm điện.
+ Nickel được dùng để chế tạo các hợp kim sử dụng trong máy móc, thiết bị.
Lời giải:
Cấu hình electron nguyên tử của các nguyên tố kim loại chuyển tiếp dãy thứ nhất có dạng [Ar]3d1÷10 4s1÷2. Nguyên tử của các nguyên tố kim loại chuyển tiếp dãy thứ nhất có electron hoá trị nằm ở phân lớp 3d và 4s.
Lời giải:
- Các kim loại chuyển tiếp dãy thứ nhất có nhiệt độ nóng chảy, khối lượng riêng, độ cứng cao hơn kim loại K và Ca.
- Thứ tự tăng dần về nhiệt độ nóng chảy, khối lượng riêng, độ cứng của các kim loại chuyển tiếp dãy thứ nhất với kim loại K và Ca là K; Ca; kim loại chuyển tiếp dãy thứ nhất.
Luyện tập trang 112 Hóa học 12: Lấy một số ví dụ về ứng dụng của sắt trong thực tế.
Lời giải:
- Sắt được sử dụng để sản xuất gang, thép và các hợp kim khác của sắt.
- Hợp chất của sắt được sử dụng để làm chất diệt sâu bọ, pha chế sơn mực, làm chất xúc tác cho phản ứng hữu cơ, làm sơn chổng gỉ,…
- Các hợp kim của sắt có nhiều ứng dụng khác nhau như
+ Sắt, manganese được dùng trong sản xuất thiết bị quốc phòng, công nghiệp, nông nghiệp, đời sống.
+ Sắt, cobalt được dùng để chế tạo nam châm điện.
Luyện tập trang 112 Hóa học 12: Hãy viết cấu hình electron của các ion: Cu2+, Fe3+, Cr3+, Mn2+.
Phương pháp giải:
Cách viết cấu hình electron nguyên tử
+ Bước 1: Xác định số electron của nguyên tử (Z).
+ Bước 2: Điền các electron vào các phân lớp theo mức năng lượng: 1s2s2p3s3p4s3d4p5s…
+ Bước 3: (Z > 20) Viết cấu hình electron theo thứ tự lớp, phân lớp: 1s2s2p3s3p3d4s4p5s…
Lời giải:
Cu2+: 1s22s22p63s23p63d9
Fe3+: 1s22s22p63s23p63d5
Cr3+: 1s22s22p63s23p63d3
Mn2+: 1s22s22p63s23p63d5
Phương pháp giải:

Lời giải:
Trong dung dịch, ion của kim loại chuyển tiếp dãy thứ nhất thường có màu.
Phương pháp giải:
Dung dịch FeSO4 trong môi trường acid làm mất màu dung dịch KMnO4.
Lời giải:
Hiện tượng: Khi nhỏ thuốc tím vào dung dịch muối Fe(II), màu hồng của thuốc tím biến mất. Sau khi kết thúc chuẩn độ, dung dịch xuất hiện màu hồng.
Câu hỏi 4 trang 113 Hóa học 12: Từ kết quả chuẩn độ, xác định nồng độ Fe2+ trong dung dịch đã pha.
Lời giải:
Giả sử thể tích dung dịch KMnO4 trong thí nghiệm đã dùng là V (L).
Þ
Theo phương trình hóa học:
Lời giải:
- Khi nhỏ dung dịch NaOH vào dung dịch CuSO4, xuất hiện kết tủa màu xanh lam.
Phương trình hóa học:
Kết tủa màu xanh lam là Cu(OH)2.
- Khi nhỏ dung dịch NaOH vào dung dịch FeCl3, xuất hiện kết tủa màu nâu đỏ.
Phương trình hóa học:
Kết tủa màu xanh lam là Fe(OH)3.
Bài tập
Bài 1 trang 114 Hóa học 12: Viết cấu hình electron của các ion: Cr2+, Fe2+, Ni2+, Co2+, Co3+.
Phương pháp giải:
Cách viết cấu hình electron nguyên tử
+ Bước 1: Xác định số electron của nguyên tử (Z).
+ Bước 2: Điền các electron vào các phân lớp theo mức năng lượng: 1s2s2p3s3p4s3d4p5s…
+ Bước 3: (Z > 20) Viết cấu hình electron theo thứ tự lớp, phân lớp: 1s2s2p3s3p3d4s4p5s…
Lời giải:
Cr2+: 1s22s22p63s23p63d4
Fe2+: 1s22s22p63s23p63d6
Ni2+: 1s22s22p63s23p63d8
Co2+: 1s22s22p63s23p63d7
Co3+: 1s22s22p63s23p63d6
Lời giải:
- Các kim loại có độ dẫn điện, dẫn nhiệt tốt nhất: Ag, Cu, Au, Al, Na.
- Nhận xét: các kim loại chuyển tiếp thuộc dãy thứ nhất có độ dẫn điện và dẫn nhiệt cao.
Lời giải:
Ta có:
Phương trình hóa học:
Theo phương trình hóa học:
Bảo toàn nguyên tố Fe:
Lý thuyết Đại cương về kim loại chuyển tiếp dãy thứ nhất
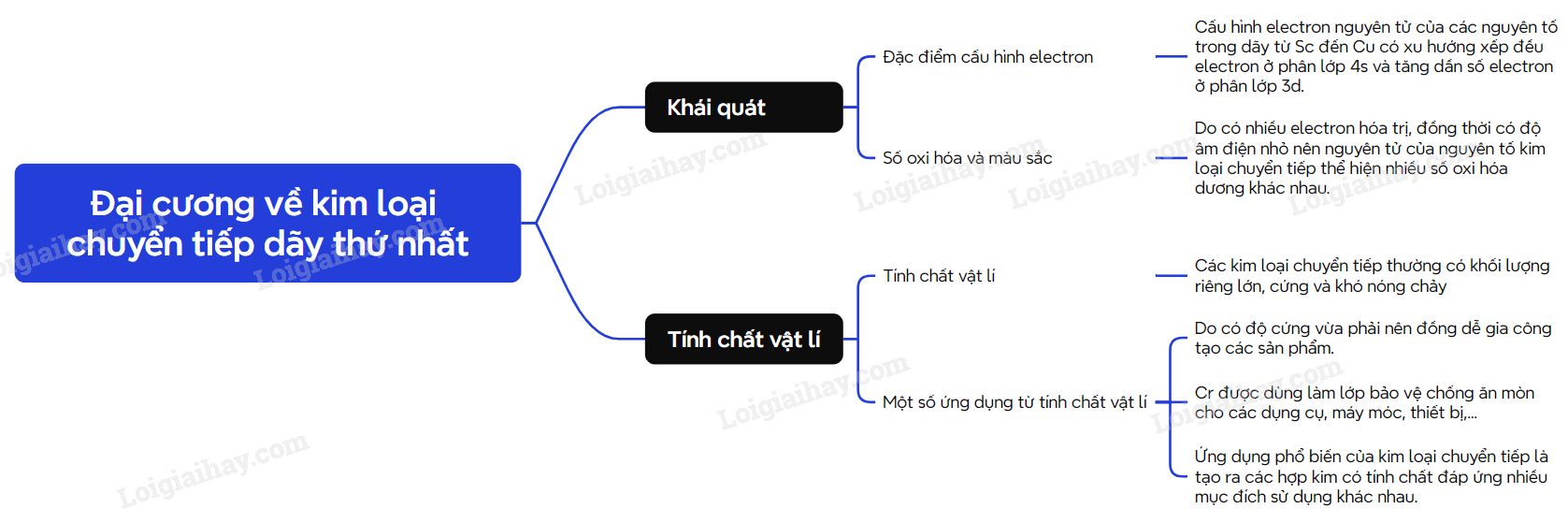
1. Đặc điểm cấu hình electron của nguyên tử kim loại chuyển tiếp dãy thứ nhất
- Kim loại chuyển tiếp dãy thứ nhất gồm các nguyên tố từ Sc đến Cu.
- Cấu hình electron nguyên tử của các nguyên tố kim loại chuyển tiếp dãy thứ nhất có dạng
2. Một số tính chất vật lí và ứng dụng của kim loại chuyển tiếp dãy thứ nhất
- Các kim loại chuyển tiếp dãy thứ nhất có nhiệt độ nóng chảy, khối lượng riêng, độ cứng cao hơn kim loại nhóm IA và nhóm IIA trong cùng chu kì.
- Hầu hết kim loại chuyển tiếp dãy thứ nhất đều có ứng dụng trong nhiều lĩnh vực khác nhau:
+ Đồng có độ dẫn điện lớn nên được dùng trong sản xuất các thiết bị như: biến thế, cầu dao điện, dây dẫn điện.
+ Chromium có độ cứng cao được dùng mạ lên các thiết bị để chống mài mòn, chế tạo hợp kim đặc biệt,….
3. Trạng thái oxi hóa và màu sắc ion của nguyên tố chuyển tiếp
- Với cấu hình, các nguyên tố chuyển tiếp thường có xu hướng thể hiện nhiều trạng thái oxi hóa.
Ví dụ: trạng thái oxi hóa thường gặp của sắt là +2, +3; của Cr là +3, +6,…
- Đa số kim loại chuyển tiếp dãy thứ nhất có nhiều trạng thái oxi hóa khác nhau.
- Trong dung dịch, ion của kim loại chuyển tiếp dãy thứ nhất thường có màu.
Sơ đồ tư duy Đại cương về kim loại chuyển tiếp dãy thứ nhất
Xem thêm các bài giải bài tập Hóa Học lớp 12 Chân trời sáng tạo hay, chi tiết khác:
Bài 15. Các phương pháp tách kim loại
Bài 16. Hợp kim – Sự ăn mòn kim loại
Bài 19. Đại cương về kim loại chuyển tiếp dãy thứ nhất
Bài 20. Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch