Lời giải bài tập Hóa học lớp 12 Bài 18: Nguyên tố nhóm IIA sách Chân trời sáng tạo hay, chi tiết sẽ giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập môn Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 18: Nguyên tố nhóm IIA
Kim loại nhóm IIA và hợp chất của chúng có những tính chất gì?
Lời giải:
- Kim loại nhóm IIA:
+ Tính chất vật lí: Nhiệt độ nóng chảy, khối lượng riêng và độ cứng của kim loại nhóm IIA cao hơn so với kim loại nhóm IA cùng chu kì. Kim loại nhóm IIA là những kim loại nhẹ (D < 5 g/cm3).
+ Tính chất hóa học: Kim loại nhóm IIA có tính khử mạnh, tính khử tăng dần từ Be đến Ba.
- Hợp chất của kim loại nhóm IIA:
+ Muối carbonate: Muối carbonate tác dụng với dung dịch acid loãng, phản ứng với H2O khi có mặt CO2. Dưới tác dụng của nhiệt, muối carbonate của kim loại nhóm IIA bị phân huỷ tạo thành oxide.
+ Muối nitrate: Khi đun nóng, muối nitrate của kim loại nhóm IIA phân huỷ thành oxide.
+ Độ bền nhiệt của muối carbonate, muối nitrate của kim loại nhóm IIA có xu hướng tăng dần từ muối của Mg2+ đến muối của Ba2+.
Lời giải:
Sự biến đổi nhiệt độ nóng chảy của kim loại nhóm IIA không theo quy luật do cấu trúc mạng tinh thể của kim loại nhóm IIA khác nhau:
+ Beryllium và magnesium có cấu trúc lục phương chặt khít;
+ Calcium và strontium có cấu trúc lập phương tâm mặt;
+ Barium có cấu trúc lập phương tâm khối.
Lời giải:
Kim loại nhóm IIA có tính khử mạnh nhưng yếu hơn kim loại nhóm IA.
Luyện tập trang 102 Hóa học 12: Hoàn thành phương trình hoá học của các phản ứng sau:
Lời giải:
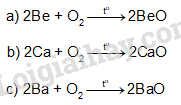
Phương pháp giải:

Lời giải:
Độ tan của các hydroxide trong nước tăng theo thứ tự:
Be(OH)2 < Mg(OH)2 < Ca(OH)2 < Sr(OH)2 < Ba(OH)2
Luyện tập trang 103 Hóa học 12: Hoàn thành phương trình hoá học của các phản ứng sau:
Phương pháp giải:
Berrylium không tác dụng với nước và hơi nước do có màng oxide bền bảo vệ bề mặt. Magnesium phản ứng chậm với nước ở nhiệt độ thường và phản ứng nhanh hơn khi đun nóng. Các kim loại Ca, Sr, Ba khử H2O ở nhiệt độ thường.
(với M là Ca, Sr hoặc Ba)
Lời giải:
Lời giải:
Muối carbonate kim loại nhóm IIA với dung dịch acid loãng giải phóng khí carbon dioxide.
Phương pháp giải:
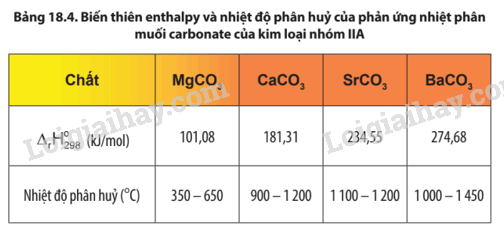
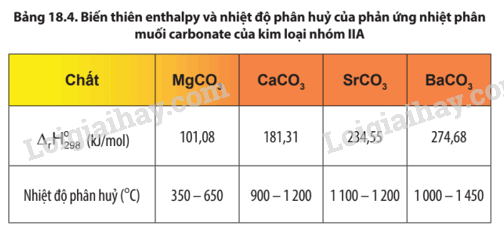
Lời giải:
Độ bền nhiệt của muối carbonate của kim loại nhóm IIA có xu hướng tăng dần từ muối của MgCO3 đến muối của BaCO3.
Phương pháp giải:
Lời giải:
- Độ bền nhiệt của muối nitrate của kim loại nhóm IIA có xu hướng tăng dần từ muối của Mg(NO3)2 đến muối của Ba(NO3)2.
- Độ bền nhiệt của muối nitrate càng lớn, biến thiên enthalpy của phản ứng nhiệt phân muối nitrate càng lớn.
Luyện tập trang 104 Hóa học 12: Hoàn thành phương trình hoá học của các phản ứng sau:
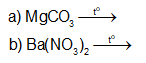
Phương pháp giải:
+ Muối carbonate: Dưới tác dụng của nhiệt, muối carbonate của kim loại nhóm IIA bị phân huỷ tạo thành oxide.
+ Muối nitrate: Khi đun nóng, muối nitrate của kim loại nhóm IIA phân huỷ thành oxide.
Lời giải:
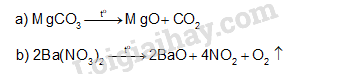
a) Vôi sống tiếp xúc lâu ngày trong không khí sẽ bị giảm chất lượng.
b) Trên bể mặt các hố vôi tôi lâu ngày thường có màng chất rắn.
Lời giải:
a) Vôi sống (CaO) để lâu ngoài không khí sẽ có phản ứng với hơi nước và carbondioxide trong không khí nên chất lượng bị giảm.
b) Các hố vôi tôi (Ca(OH)2) khi để lâu ngày sẽ có phản ứng với CO2 trong không khí tạo một lớp màng rắn CaCO3.
Lời giải:
- Hiện tượng: Ống nghiệm (1) chứa kết tủa CaSO4 xuất hiện kết tủa chậm hơn so với ống nghiệm (2) chứa kết tủa BaSO4.
- Kết luận: CaSO4 có độ tan lớn hơn BaSO4.
- Giải thích: Vì CaSO4 ít tan, BaSO4 không tan nên kết tủa CaSO4 xuất hiện kết tủa chậm hơn so với kết tủa BaSO4.
Phương pháp giải:
Lời giải:
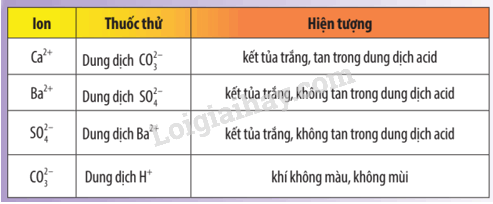
- Ống nghiệm (1): xuất hiện kết tủa trắng BaSO4.
- Ống nghiệm (2): xuất hiện kết tủa trắng CaCO3, sau đó kết tủa tan và xuất hiện bọt khí CO2 không màu.
- Ống nghiệm (3): xuất hiện kết tủa trắng BaSO4.
- Ống nghiệm (4): xuất hiện bọt khí CO2 không màu.
Lời giải:
- Trích các dung dịch trên làm mẫu thử và đánh số thứ tự.
- Nhỏ dung dịch HCl vào các mẫu thử:
+ Mẫu thử xuất hiện bọt khí không màu chứa dung dịch Na2CO3.
+ Mẫu thử không xuất hiện hiện tượng chứa dung dịch K2SO4 và dung dịch Ba(NO3)2.
- Nhỏ dung dịch Ba(OH)2 vào hai mẫu thử chứa dung dịch K2SO4 và dung dịch Ba(NO3)2:
+ Mẫu thử xuất hiện kết tủa trắng chứa dung dịch K2SO4.
+ Mẫu thử không hiện tượng chứa dung dịch Ba(NO3)2.
Phương trình hóa học:
Lời giải:
Học sinh tự vẽ sơ đồ từ duy với các từ khóa được tìm kiếm trong mục 3 trang 107 sách giáo khoa.
Vận dụng trang 107 Hóa học 12: Hãy tìm hiểu những thực phẩm có thể giúp bổ sung calcium cho cơ thể?
Lời giải:
Thực phẩm có thể giúp bổ sung calcium cho cơ thể:
+ Sữa và các chế phẩm từ sữa (phô mai, sữa chua).
+ Cá mòi.
+ Rau có màu xanh đậm (cải xoăn, cái búp, súp lơ xanh,...).
+ Đậu phụ.
+ Các loại đậu, hạt dầu như hướng dương, hạnh nhân, đậu đen, đậu nành,...
Phương pháp giải:
Lời giải:
Nước cứng toàn phần chứa tính cứng của nước cứng tạm thời và nước cứng vĩnh cửu nên khó loại bỏ nhất.
Lời giải:
Giặt áo quần bằng xà phòng (sodium stearate C17H35COONa) trong nước cứng sẽ tạo ra muối không tan là calcium stearate (C17H35COO)2Ca, chất này bám trên vải sợi, làm cho quần áo mau mục nát. Mặt khác, nước cứng làm cho xà phòng có ít bọt, giảm khả năng tẩy rửa của xà phòng nên giặt áo quần bằng nước cứng sẽ tốn xà phòng, nước xả vải hơn khi dùng nước mềm.
Câu hỏi 12 trang 108 Hóa học 12: Đề xuất cách làm mềm nước có tính cứng toàn phần?
Lời giải:
Để làm mềm nước cứng toàn phần, ta sử dụng Na2CO3 hoặc Na3PO4.
;
;
Bài tập
Bài 1 trang 109 Hóa học 12: Nước cứng tạm thời có chứa chất nào sau đây?
A. Ca(HCO3)2.
B. MgSO4.
C. CaCl2.
D. MgCl2.
Lời giải:
Nước cứng tạm thời có chứa Ca(HCO3)2.
→ Chọn A.
Lời giải:
Bài 3 trang 109 Hóa học 12: Viết các phương trình hoá học cho các phản ứng sau:
a) Calcium oxide tác dụng với dung dịch hydrochloric acid loãng.
b) Dung dịch sodium carbonate tác dụng với dung dịch calcium hydroxide.
Lời giải:
a)
b)
Lời giải:
- Y là hợp chất của calcium có nhiều ở dạng đá vôi, đá hoa,... nên Y là CaCO3.
Vì Z có trong thành phần không khí và thường dùng để chữa cháy và khi cho CaCO3 phản ứng với dung dịch acid mạnh thu được Z nên Z là CO2.
- Phương trình hóa học:
Lý thuyết Nguyên tố nhóm IIA
A. Đơn chất
1. Vị trí, cấu tạo và trạng thái tự nhiên
- Nhóm IIA gồm các nguyên tố: Be, Mg, Ca, Sr, Ba và Ra.
- Cấu hình electron lớp ngoài cùng của kim loại nhóm IIA là ns2
- Kim loại nhóm IIA tồn tại trong tự nhiên ở dạng hợp chất.
2. Tính chất vật lí
- Nhiệt độ nóng chảy, khối lượng riêng và độ cứng của kim loại nhóm IIA cao hơn so với kim loại nhóm IA cùng chu kì. Kim loại nhóm IIA là những kim loại nhẹ (D < 5g/cm3)
3. Tính chất hóa học
a) Phản ứng với oxygen
- Khi đốt nóng trong oxygen hoặc trong không khí, các kim loại nhóm IIA đều bốc cháy, tạo ra oxide theo phương trình hóa học tổng quát sau:
2M(s) + O2(g) 2MO(s)
- Khi cháy, các kim loại nhóm IIA cho ngọn lửa có màu đặc trưng.
b) Phản ứng với nước
Be không tan trong nước, Mg phản ứng với nước rất chậm ở nhiệt độ thường, phản ứng mạnh hơn khi đun nóng. Ca, Sr, Ba phản ứng mạnh với nước ở nhiệt độ thường
B. Hợp chất
1. Tính chất của muối carbonate, nitrate
a) Muối carbonate
- Muối carbonate của các nguyên tố Mg, Ca, Sr, Ba phản ứng với dung dịch acid, với nước có carbon dioxide hòa tan.
Ví dụ: CaCO3(s) + 2HCl(aq) CaCl2(aq) + H2O(l) + CO2(g)
CaCO3(s) + H2O(l) + CO2(aq) Ca(HCO3)2(aq)
- Các muối carbonate bị nhiệt phân, tạo thành oxide kim loại và khí carbon dioxide:
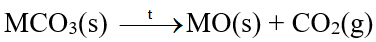
b) Muối nitrate
- Các muối nitrate của nguyên tố nhóm IIA bị nhiệt phân tạo oxide kim loại, khí nitrogen dioxide và oxygen.
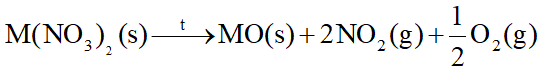
- Độ bền nhiệt của các muối nitrate có xu hướng tăng từ Mg(NO3)2 đến Ba(NO3)2.
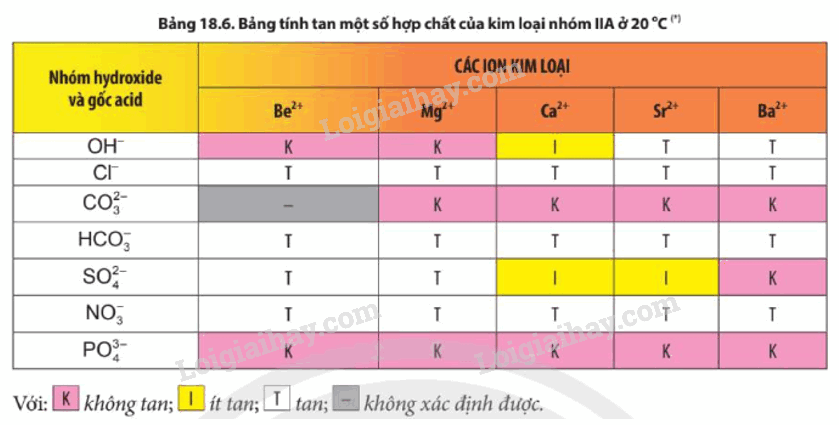
2. Tính tan của các muối carbonate, sulfate, nitrate
- Các muối nitrate đều tan
- Trừ BeCO3, các muối carbonate khác không tan trong nước.
- Các muối BeSO4, MgSO4 tan; SrSO4 và CaSO4 ít tan; BaSO4 không tan
3. Ứng dụng
- Magnesium nhẹ hơn so với Al, vì vậy hợp kim của Mg được sử dụng trong chế tạo máy bay, ô tô.
- Đá vôi là thành phần chính là calcium carbonate, được dùng để sản xuất vôi, xi măng, làm vật liệu xây dựng,…
- Vôi sống làm vật liệu xây dựng, tẩy uế, sát trùng.
- Nước vôi được dùng xử lí nước, giảm tính cứng của nước.
- Thạch cao có thành phần chính là calcium sulfate được sử dụng làm vách, trần thạch cao để tăng tính thẩm mĩ trong xây dựng.
- Khoáng vật apatite chứa calcium, được dùng chế tạo phân bón cho nông nghiệp, làm nguyên liệu sản xuất phân lân.
- Vai trò một số hợp chất của calcium trong cơ thể con người: calcium là thành phần chính của xương và răng; ion calcium có trong muối phosphate phức tạp, hydroxyapatide, ion Ca2+ trong cơ thể người có chức năng kích hoạt quá trình trao đổi chất, đóng vai trò quan trọng trong hoạt động của tim, đông máu, co cơ và truyền xung thần kinh.
4. Nước cứng và cách làm mềm nước cứng
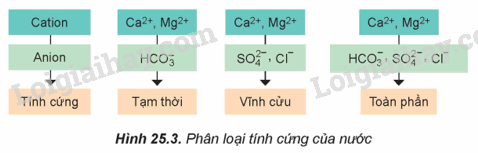
Phân loại nước cứng
- Nước cứng là loại nước chứa ion Ca2+ và Mg2+ với hàm lượng vượt quá mức cho phép.
- Nước cứng tạm thời được gây nên bởi các muối Ca(HCO3)2 và Mg(HCO3)2.
- Nước cứng vĩnh cửu được gây nên bởi các muối sulfate, chloride của calcium và magnesium.
- Nước cứng toàn phần bao gồm nước cứng tạm thời và nước cứng vĩnh cửu.
- Tác hại của nước cứng
+ Trong đời sống hằng ngày: nước cứng làm giảm khả năng tạo bọt của xà phòng, giảm tác dụng giặt rửa, làm các dụng cụ đun nấu dễ bị đóng cặn, tiêu hao năng lượng. Nếu sử dụng nước cứng để nấu ăn sẽ làm thực phẩm lâu chín và giảm mùi vị.
+ Trong bảo vệ sức khỏe: dùng nước cứng tắm gội hằng ngày sẽ gây khô da, khô tóc hay mẩn ngứa, gây hại sức khỏe.
+ Trong công nghiệp: trong các nồi áp suất của tua bin hơi nước ở nhiều nhà máy, nước cứng tạo cặn là CaCO3, cản trở quá trình dẫn nhiệt.
- Các phương pháp làm mềm nước cứng:
1. Phương pháp kết tủa
Cơ sở của phương pháp này là chuyển cation Ca2+, Mg2+ trong nước về dạng chất không tan, có thể dễ dàng tách ra khỏi nước bằng cách lắng, lọc.
+ Khi đun sôi nước cứng, muối Ca(HCO3)2 và Mg(HCO3)2 bị phân hủy tạo ra muối không tan, làm mất tính cứng tạm thời của nước.
+ Dùng Ca(OH)2 với lượng vừa đủ để phản ứng với muối Ca(HCO3)2 và Mg(HCO3)2 tạo ra hợp chất không tan, làm mất tính cứng tạm thời của nước.
+ Dùng Na2CO3 hoặc Na3PO4 để làm mất tính cứng tạm thời và tính cứng vĩnh cửa của nước.
2. Phương pháp trao đổi ion
- Thực hiện bằng cách cho nước cứng đi qua lớp vật liệu hay màng vật liệu trao đổi ion. Các vật liệu này có chứa cation kim loại như Na+. Khi cho nước cứng đi qua vật liệu, các cation Ca2+ và Mg2+ đẩy cation Na+ ra khỏi vật liệu. Các cation Ca2+, Mg2+ bị giữ lại trên vật liệu.
- Phương pháp trao đổi ion làm giảm được cả tính cứng vĩnh cửu.
Sơ đồ tư duy Nguyên tố nhóm IIA
Xem thêm các bài giải bài tập Hóa Học lớp 12 Chân trời sáng tạo hay, chi tiết khác:
Bài 15. Các phương pháp tách kim loại
Bài 16. Hợp kim – Sự ăn mòn kim loại
Bài 19. Đại cương về kim loại chuyển tiếp dãy thứ nhất
Bài 20. Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch