Với lời giải SBT Hóa học 11 trang 23 chi tiết trong Bài 7: Sulfuric acid và muối sulfate Cánh diều giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 7: Sulfuric acid và muối sulfate
Bài 7.2 trang 23 SBT Hoá học 11: Những đặc điểm nào sau đây về muối sulfate là đúng?
(a) Nhiều muối sulfate tan tốt trong nước nhưng một số muối như CaSO4, BaSO4 rất ít tan trong nước.
(b) Magnesium sulfate được dùng làm thuốc điều trị bệnh liên quan đến hồng cầu, dùng làm chất hút mồ hôi tay cho các vận động viên,…
(c) Calcium sulfate là thành phần chính của các loại thạch cao. Phân tử chất này thường ngậm nước với số lượng các phân tử H2O khác nhau, tạo ra các loại thạch cao có ứng dụng khác nhau.
(d) Barium sulfate là chất rắn màu trắng, hầu như không tan trong nước. Chất này được dùng tạo màu trắng cho các loại giấy chất lượng cao.
Lời giải:
Đáp án đúng là: (a), (c), (d).
|
Cột A |
Cột B |
|
a) Sulfuric acid |
1. Tan tốt trong nước. |
|
b) Thạch cao |
2. Là chất rắn ở điều kiện thường. |
|
c) Ammonium sulfate (thành phần chính trong một loại phân đạm) |
3. Dùng để cố định xương bị gãy (bó bột). |
|
4. Là chất điện li mạnh. |
|
|
5. Phản ứng dễ dàng với dung dịch base như nước vôi, barium hydroxide. |
|
|
6. Hòa tan được nhiều kim loại. |
Lời giải:
Đáp án đúng là: a – 1, 4, 5, 6; b – 2, 3; c – 1, 2, 4, 5.
Bài 7.4 trang 23 SBT Hoá học 11: Hình bên là công thức Lewis của H2SO4.
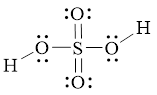
a) Dựa vào công thức Lewis của H2SO4, hãy cho biết số oxi hóa của nguyên tử sulfur trong phân tử.
b) Khi tham gia phản ứng, H2SO4 không thể tạo ra các sản phẩm chứa sulfur có số oxi hóa lớn hơn hoặc bằng 7. Giải thích.
c) Hydrogen iodide có tính khử khá mạnh. Hãy dự đoán khí này có phản ứng với sulfuric acid đặc không. Giải thích.
Lời giải:
a) Do 6 electron hóa trị của S bị lệch về phía các nguyên tử O nên S có số oxi hóa là +6.
b) S chỉ có 6 electron hóa trị nên không thể có số oxi hóa lớn hơn 6.
c) Có do H2SO4 cũng là chất có tính oxi hóa mạnh.
8HI + H2SO4 → H2S + 4I2 + 4H2O
a) Tiếp xúc với lá kim loại hoạt động bị phủ bởi lớp oxide kim loại (chẳng hạn, lá kẽm (zinc) bị phủ bởi lớp zinc oxide).
b) Tiếp xúc vói mẩu đá vôi hay mẩu phấn viết bảng.
c) Tiếp xúc bột baking soda (sodium hydrogencarbonate).
d) Được cho vào nước vôi trong, Ca(OH)2.
Lời giải:
a) Lớp oxide tan dần, sau đó lá kim loại cũng tan và có bọt khí xuất hiện.
H2SO4(aq) + ZnO(s) → ZnSO4(aq) + H2O(l)
H2SO4(aq) + Zn(s) → ZnSO4(aq) + H2(g)
b) Mẩu đá vôi tan ra, dung dịch sủi bọt khí, dung dịch sau phản ứng có màu trắng đục, để lâu sẽ lắng thành lóp bột màu trắng.
H2SO4(aq) + CaCO3(s) → CaSO4(s) + CO2(g) + H2O(l)
c) Bột baking soda tan ra, dung dịch sủi bọt khí, sau phản ứng thu được dung dịch trong suốt.
H2SO4(aq) + 2NaHCO3(s) → Na2SO4(aq) + 2CO2(g) + 2H2O(l)
d) Nước vôi trong bị đục.
H2SO4(aq) + Ca(OH)2(aq) → CaSO4(s) + 2H2O(l)
Xem thêm lời giải Sách bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Bài 7.1 trang 22 SBT Hoá học 11: Những phát biểu nào sau đây là đúng?...
Bài 7.2 trang 23 SBT Hoá học 11: Những đặc điểm nào sau đây về muối sulfate là đúng?...
Bài 7.4 trang 23 SBT Hoá học 11: Hình bên là công thức Lewis của H2SO4...
Xem thêm các bài giải SBT Hóa học lớp 11 Cánh diều hay, chi tiết khác: