Với lời giải SBT Hóa học 11 trang 29 chi tiết trong Bài 7: Sulfuric acid và muối sulfate sách Chân trời sáng tạo giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 7: Sulfuric acid và muối sulfate
A. 40%.
B. 60%.
C. 25%.
D. 75%.
Lời giải:
Sơ đồ phản ứng:
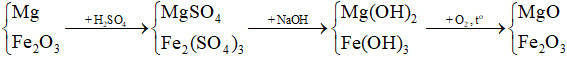
Ta thấy khối lượng ban đầu (Mg và Fe2O3) và khối lượng chất rắn không đổi (MgO, Fe2O3) chênh lệch nhau ở khối lượng của nguyên tố oxygen.
Bảo toàn nguyên tố O, ta có: nMg = nO = 0,5 (mol)
Lời giải:
Khối lượng bình đựng dung dịch H2SO4 đặc để trong không khí ẩm lâu ngày tăng lên do H2SO4 đặc hút nước trong không khí ẩm.
Lời giải:
Khi bị bỏng acid, cần nhanh chóng bỏ quần áo bị dính acid, rửa ngay bằng nước sạch khoảng 20 phút. Sau đó, cần nhanh chóng chuyển người bị bỏng đến cơ sở y tế gần nhất để được theo dõi và điều trị.
Lời giải:
Trong công đoạn sản xuất SO3 từ SO2 để thực hiện cần có điều kiện phản ứng là nhiệt độ 450 – 500 oC, xúc tác vanadium (V) oxide (V2O5).
Với xúc tác là các ion kim loại trong khói bụi, SO2 bị oxi hóa và hòa tan trong nước mưa tạo thành sulfuric acid
![]()
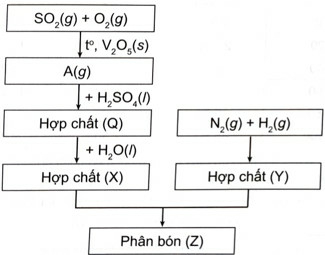
Lời giải:
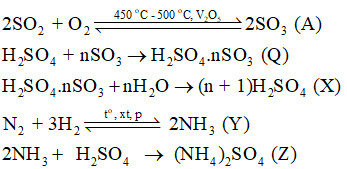
Xem thêm lời giải Sách bài tập Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Bài 7.1 trang 28 SBT Hóa học 11: Kim loại nào sau đây không tác dụng với dung dịch H2SO4 loãng?...
Bài 7.4 trang 28 SBT Hóa học 11: Cách pha loãng dung dịch H2SO4 đặc nào sau đây đúng?...
Xem thêm các bài giải SBT Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Bài 6: Sulfur và sulfur dioxide
Bài 7: Sulfuric acid và muối sulfate