Với lời giải SBT Hóa học 11 trang 25 chi tiết trong Bài 6: Một số hợp chất của nitrogen với oxygen sách Kết nối tri thức giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 6: Một số hợp chất của nitrogen với oxygen
Bài 6.21 trang 25 Sách bài tập Hóa học 11: a) Viết phương trình hoá học xảy ra khi cho dung dịch loãng lần lượt tác dụng với các chất: NaHCO3, Cu.
b) Trình bày phương pháp hoá học phân biệt ba dung dịch: HNO3, NaNO3, HCl.
Lời giải:
a) Các phương trình hoá học:
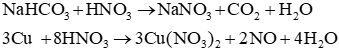
b) Sử dụng lần lượt hai thuốc thử là quỳ tím và dung dịch silver nitrate như sau:
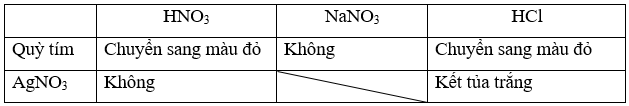
Phương trình hóa học:
AgNO3 + HCl → AgCl↓ + HNO3
Bài 6.22 trang 25 Sách bài tập Hóa học 11: Xét các phản ứng tạo thành oxide của nitrogen:
a) Hãy cho biết phản ứng nào toả nhiệt, phản ứng nào thu nhiệt.
b) Hãy tính của phản ứng:
Từ kết quả thu được, hãy tính của NO2 (g)
Lời giải:
a) Phản ứng thứ nhất thu nhiệt, phản ứng thứ hai tỏa nhiệt.
b)
Nhiệt tạo thành của NO2(g) là biến thiên enthalpy của phản ứng:
Như vậy,
Bài 6.23 trang 25 Sách bài tập Hóa học 11: Sử dụng các hoá chất, dụng cụ: dung dịch nitric acid 20%, cân, tủ hút khí độc, cốc, đũa thuỷ tinh, phễu lọc, giấy lọc. Trình bày các bước xác định gần đúng hàm lượng vàng (gold) có trong hợp kim Au-Ag, trong đó hàm lượng vàng < 30% về khối lượng. Viết các phương trình hoá học xảy ra.
Lời giải:
Bước 1: Cân hợp kim, ghi khối lượng m1.
Bước 2: Ngâm hợp kim vào cốc đựng dung dịch HNO3 20% dư để hòa tan Ag, còn lại Au không tan (thực hiện trong tủ hút).
Bước 3: Lọc lấy phần chất rắn không tan, rửa và làm khô.
Bước 4: Cân khối lượng vàng thu được, ghi khối lượng m2, tính gần đúng hàm lượng vàng trong hợp kim theo công thức:
Bài 6.24 trang 25 Sách bài tập Hóa học 11: Xét phản ứng:
Hãy tính của phản ứng và cho biết phản ứng là toả nhiệt hay thu nhiệt. (Biết nhiệt tạo thành của NO2 (g), H2O (l) và HNO3(l) lần lượt là 33,2 kJ / mol, -285,8 kJ / mol và -174,1 kJ / mol.
Lời giải:
Vậy, phản ứng trên là phản ứng thu nhiệt.
Bài 6.25 trang 25 Sách bài tập Hóa học 11: Trong công nghiệp, nitric acid được sản xuất theo 3 giai đọ̣an của quá trình Ostwald.
Giai đoạn 1: Oxi hoá NH3 thành NO.
Nung nóng hỗn hợp gồm 1 phần thể tích ammonia và 9 phần thể tích không khí tới nhiệt độ khoảng 900oC (xúc tác Pt-Rh):
Giai đoạn 2: Oxi hoá NO thành NO2.
Dẫn hỗn hợp khí sau giai đoạn 1 qua hệ thống làm mát để hạ nhiệt độ:
Giai đoạn 3: Tổng hợp nitric acid.
Khí NO sinh ra ở giai đoạn 3 được dẫn quay về giai đoạn 2 của chu trình sản xuất.
a) Xác định chất khử, chất oxi hoá trong 3 giai đoạn sản xuất trên.
b) Tại sao ban đầu cần trộn ammonia với không khí theo tỉ lệ thể tích 1:9 ? (Biết không khí chứa 21% thể tích oxygen.)
Lời giải:
a) (1)
Chất oxi hóa là O2, chất khử là NH3.
(2)
Chất oxi hóa là O2, chất khử là NO.
(3)
NO2 vừa là chất khử vừa là chất oxi hóa.
b) Tổ hợp phản ứng của 3 giai đoạn: (1).3 + (2).6 + (3).4, thu được phản ứng chung:
12NH3 + 21O2 → 8HNO3 + 4NO + 14H2O
Tỉ lệ thể tích NH3 : O2 =
Tỉ lệ thể tích NH3 : Không khí gần bằng 1 : 9 (có lấy dư không khí).
Xem thêm lời giải Sách bài tập Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 6.1 trang 22 Sách bài tập Hóa học 11: Oxide của nitrogen được tạo thành ở nhiệt độ rất cao, khi nitrogen có trong không khí bị oxi hoá được gọi là....
Bài 6.2 trang 22 Sách bài tập Hóa học 11: Oxide của nitrogen được tạo thành khi nguyên tố nitrogen trong nhiên liệu hoặc sinh khối kết hợp với oxygen dư thừa trong không khí được gọi là....
Bài 6.3 trang 22 Sách bài tập Hóa học 11: Oxide của nitrogen được tạo thành khi nitrogen trong không khí tác dụng với các gốc tự do được gọi là...
Bài 6.4 trang 22 Sách bài tập Hóa học 11: Nitrogen monoxide được tạo thành khi mưa dông kèm theo sấm sét do phản ứng giữa nitrogen và oxygen trong không khí được gọi là....
Bài 6.5 trang 22 Sách bài tập Hóa học 11: Mưa acid là hiện tượng nước mưa có pH thấp hơn 5,6 (giá trị pH của khí carbon dioxide bão hoà trong nước). Hai tác nhân chính gây mưa acid là...
Bài 6.6 trang 23 Sách bài tập Hóa học 11: Số oxi hoá thấp nhất của nitrogen là...
Bài 6.7 trang 23 Sách bài tập Hóa học 11: Phân tử nào sau đây có chứa một liên kết cho - nhận?....
Bài 6.8 trang 23 Sách bài tập Hóa học 11: Acid nào sau đây thể hiện tính oxi hoá mạnh khi tác dụng với chất khử?...
Bài 6.9 trang 23 Sách bài tập Hóa học 11: Kim loại nào sau đây không tác đụng với nitric acid?....
Bài 6.10 trang 23 Sách bài tập Hóa học 11:Hiện tượng phú dưỡng là một biểu hiện của môi trường ao, hồ bị ô nhiễm do dư thừa các chất dinh dưỡng. Sự dư thừa dinh dưỡng chủ yếu do hàm lượng các ion nào sau đây vượt quá mức cho phép?....
Bài 6.11 trang 23 Sách bài tập Hóa học 11:Cho các nhận định sau về tính chất hoá học của nitric acid: (1) có tính acid mạnh; (2) có tính acid yếu; (3) có tính oxi hoá mạnh; (4) có tính khử mạnh. Số nhận định đúng là...
Bài 6.12 trang 23 Sách bài tập Hóa học 11: Phát biểu nào sau đây không đúng?...
Bài 6.13 trang 23 Sách bài tập Hóa học 11: Phát biểu nào sau đây đúng?...
Bài 6.14 trang 24 Sách bài tập Hóa học 11: Xét phản ứng trong quá trình tạo ra NOx nhiệt:....
Bài 6.15 trang 24 Sách bài tập Hóa học 11: Xét cân bằng tạo ra nitrogen(I) oxide ở nhiệt độ 2000oC:...
Bài 6.16 trang 24 Sách bài tập Hóa học 11: Cho các nhận định sau về cấu tạo phân tử nitric acid:....
Bài 6.17 trang 24 Sách bài tập Hóa học 11: Nitric acid dễ bị phân huỷ bởi ánh sáng hoặc nhiệt độ, tạo thành các sản phẩm là....
Bài 6.18 trang 24 Sách bài tập Hóa học 11: Để điều chế được silver nitrate từ một mẫu silver (bạc) tinh khiết, cần hoà tan mẫu silver vào dung dịch nào sau đây?....
Bài 6.19 trang 24 Sách bài tập Hóa học 11: Trong công nghiệp, quá trình sản xuất Ca(NO3)2 dùng làm phân bón được thực hiện bằng phản ứng giữa dung dịch HNO3 với hợp chất phổ biến, giá rẻ nào sau đây?....
Bài 6.20 trang 24 Sách bài tập Hóa học 11: Cho dung dịch HNO3 tác dụng với các chất sau: NH3, CaCO3, Ag, NaOH. Số phản ứng trong đó HNO3 đóng vai trò acid Brønsted là?...
Bài 6.21 trang 25 Sách bài tập Hóa học 11: a) Viết phương trình hoá học xảy ra khi cho dung dịch loãng lần lượt tác dụng với các chất: NaHCO3, Cu.....
Bài 6.22 trang 25 Sách bài tập Hóa học 11: Xét các phản ứng tạo thành oxide của nitrogen:....
Bài 6.23 trang 25 Sách bài tập Hóa học 11: Sử dụng các hoá chất, dụng cụ: dung dịch nitric acid 20%, cân, tủ hút khí độc, cốc, đũa thuỷ tinh, phễu lọc, giấy lọc. Trình bày các bước xác định gần đúng hàm lượng vàng (gold) có trong hợp kim Au-Ag, trong đó hàm lượng vàng < 30% về khối lượng. Viết các phương trình hoá học xảy ra....
Bài 6.24 trang 25 Sách bài tập Hóa học 11: Xét phản ứng:...
Bài 6.25 trang 25 Sách bài tập Hóa học 11: Trong công nghiệp, nitric acid được sản xuất theo 3 giai đọ̣an của quá trình Ostwald....
Xem thêm các bài giải SBT Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 5: Ammonia. Muối ammonium
Bài 6: Một số hợp chất của nitrogen với oxygen
Bài 7: Sulfur và sulfur dioxide
Bài 8: Sulfuric acid và muối sulfate
Bài 9: Ôn tập chương 2
Bài 10: Hợp chất hữu cơ và hoá học hữu cơ