Với lời giải SBT Hóa học 11 trang 10 chi tiết trong Bài 2: Cân bằng trong dung dịch nước sách Kết nối tri thức giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 2: Cân bằng trong dung dịch nước
Bài 2.2 trang 10 SBT Hóa 11: Trong dung dịch trung hoà về điện, tổng đại số điện tích của các ion bằng không. Dung dịch có chứa 0,01 mol Mg2+; 0,01 mol Na+; 0,02 mol Cl- và x mol SO42-. Giá trị của x là
A. 0,01.
B. 0,02.
C. 0,05.
D. 0,005.
Lời giải:
Đáp án đúng là: D
Theo định luật bảo toàn điện tích có:
2.0,01 + 0,01 = 0,02 + 2.x
x = 0,005.
Bài 2.3 trang 10 SBT Hóa 11: Trong dung dịch nước, cation kim loại mạnh, gốc acid mạnh không bị thuỷ phân, còn cation kim loại trung bình và yếu bị thuỷ phân tạo môi trường acid, gốc acid yếu bị thuỷ phân tạo môi trường base. Dung dịch muối nào sau đây có pH > 7?
A. KNO3.
B. K2SO4.
C. Na2CO3.
D. NaCl.
Lời giải:
Đáp án đúng là: C
CO32- là gốc acid yếu nên bị thủy phân tạo môi trường base
Bài 2.4 trang 10 SBT Hóa 11: Trong các dung dịch acid sau có cùng nồng độ 0,1 M, dung dịch nào có pH cao nhất?
A. HF.
B. HCl.
C. HBr.
D. HI.
Lời giải:
Đáp án đúng là: A
Dung dịch acid càng yếu thì pH càng cao.
Độ mạnh của acid giảm dần theo dãy sau: HI > HBr > HCl > HF.
Bài 2.5 trang 10 SBT Hóa 11: Tại khu vực bị ô nhiễm, pH của nước mưa đo được là 4,5 còn pH của nước mưa tại khu vực không bị ô nhiễm là 5,7. Nhận xét nào sau đây không đúng?
A. Nồng độ ion H+ dung dịch nước mưa bị ô nhiễm là 10-4,5.
B. Nồng độ ion H+ trong dung dịch nước mưa không bị ô nhiễm là 10-5,7.
C. Nồng độ ion H+ trong nước mưa bị ô nhiễm thấp hơn so với trong nước mưa không bị ô nhiễm.
D. Nồng độ ion OH- trong nước mưa bị ô nhiễm thấp hơn hơn so với trong nước mưa không bị ô nhiễm.
Lời giải:
Đáp án đúng là: C
Nồng độ ion H+ trong nước mưa bị ô nhiễm là [H+] = - log[H+] = 10-4,5.
Nồng độ ion H+ trong nước mưa không bị ô nhiễm là [H+] = - log[H+] = 10-5,7.
Vậy nồng độ H+ trong nước mưa không bị ô nhiễm thấp hơn so với trong nước mưa bị ô nhiễm.
Bài 2.6 trang 10 SBT Hóa 11: Viết phương trình điện li của các chất sau:
- Acid yếu: HCOOH, HCN; acid mạnh: HCl, HNO3.
- Base mạnh: KOH, Ba(OH)2 ; base yếu: Cu(OH)2.
- Muối: KNO3, Na2CO3, FeCl3.
Lời giải:
Phương trình điện li các chất:
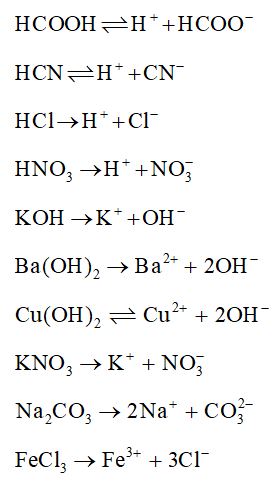
Bài 2.7 trang 10 SBT Hóa 11: Dựa vào thuyết acid-base của Brønsted-Lowry, hãy xác định acid, base trong các phản ứng sau:
a)
b)
c)
d)
Lời giải:
a)
Phản ứng thuận: HCOOH là acid, H2O là base; phản ứng nghịch: HCOO- là base, H3O+ là acid.
b)
Phản ứng thuận: HCN là acid, H2O là base; phản ứng nghịch: CN- là acid, H3O+ là base.
c)
Phản ứng thuận: H2O là acid, S2- là base; phản ứng nghịch: HS- là acid, là OH- base.
d)
Phản ứng thuận: H2O là acid, (CH3)2NH là base; phản ứng nghịch: (CH3)2NH2+ là acid, OH- là base.
Xem thêm lời giải Sách bài tập Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 2.1 trang 9 SBT Hóa 11: Thêm nước vào 10 mL dung dịch NaOH 1,0 mol/L, thu được 1000 mL dung dịch A. Dung dịch A có pH thay đổi như thế nào so với dung dịch ban đầu?...
Bài 2.2 trang 10 SBT Hóa 11: Trong dung dịch trung hoà về điện, tổng đại số điện tích của các ion bằng không. Dung dịch có chứa 0,01 mol Mg2+; 0,01 mol Na+; 0,02 mol Cl- và x mol SO42-. Giá trị của x là...
Bài 2.3 trang 10 SBT Hóa 11: Trong dung dịch nước, cation kim loại mạnh, gốc acid mạnh không bị thuỷ phân, còn cation kim loại trung bình và yếu bị thuỷ phân tạo môi trường acid, gốc acid yếu bị thuỷ phân tạo môi trường base. Dung dịch muối nào sau đây có pH > 7?...
Bài 2.4 trang 10 SBT Hóa 11: Trong các dung dịch acid sau có cùng nồng độ 0,1 M, dung dịch nào có pH cao nhất?...
Bài 2.5 trang 10 SBT Hóa 11: Tại khu vực bị ô nhiễm, pH của nước mưa đo được là 4,5 còn pH của nước mưa tại khu vực không bị ô nhiễm là 5,7. Nhận xét nào sau đây không đúng?...
Bài 2.6 trang 10 SBT Hóa 11: Viết phương trình điện li của các chất sau:...
Bài 2.7 trang 10 SBT Hóa 11: Dựa vào thuyết acid-base của Brønsted-Lowry, hãy xác định acid, base trong các phản ứng sau:...
Bài 2.8 trang 11 SBT Hóa 11: Cho dung dịch HCl 1 M (dung dịch A) và dung dịch NaOH 1 M (dung dịch B )...
Bài 2.9 trang 11 SBT Hóa 11: Một dung dịch baking soda có pH = 8,3....
Bài 2.10 trang 11 SBT Hóa 11: Aspirin là một loại thuốc có thành phần chính là acetylsalicylic acid. Nếu hoà tan thuốc này vào nước, người ta xác định được pH của dung dịch tạo thành là 2,8 . Tính nồng độ H+ và nồng OH- của dung dịch tạo thành....
Bài 2.11 trang 11 SBT Hóa 11: Hoà tan hoàn toàn a gam CaO vào nước thu được 500 mL dung dịch nước vôi trong (dung dịch A ). Chuẩn độ 5 mL dung dịch A bằng HCl 0,1 M thấy hết 12,1 mL...
Bài 2.12 trang 11 SBT Hóa 11: Vỏ trứng có chứa calcium ở dạng CaCO3. Để xác định hàm lượng CaCO3 trong vỏ trứng, trong phòng thí nghiệm người ta có thể làm như sau:...
Bài 2.13 trang 11 SBT Hóa 11: Nabica là một loại thuốc có thành phần chính là NaHCO3, được dùng để trung hoà bớt lượng acid HCl dư trong dạ dày...
Bài 2.14 trang 12 SBT Hóa 11: Một học sinh thực hiện thí nghiệm sau: Lấy 10 mL dung dịch HCl 0,2 M cho vào 5 mL dung dịch NH3 thu được dung dịch A. Chuẩn độ lượng HCl dư trong dung dịch A bằng dung dịch NaOH 0,1 thấy phản ứng hết 10,2 mL. Tính nồng độ của dung dịch NH3 ban đầu...
Xem thêm các bài giải SBT Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 1: Khái niệm về cân bằng hoá học
Bài 2: Cân bằng trong dung dịch nước
Bài 3: Ôn tập chương 1
Bài 4: Nitrogen
Bài 5: Ammonia. Muối ammonium
Bài 6: Một số hợp chất của nitrogen với oxygen