Với giải sách bài tập Hóa học 11 Bài 12: Alkane sách Cánh diều hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 12: Alkane
Bài 12.1 trang 38 SBT Hóa học 11: Phát biểu nào sau đây là đúng?
A. Những hợp chất mà trong phân tử chỉ có liên kết đơn là hydrocarbon no.
B. Hydrocarbon chỉ có liên kết đơn trong phân tử là hydrocarbon no.
C. Hydrocarbon có các liên kết đơn trong phân tử là hydrocarbon no.
D. Hydrocarbon có ít nhất một liên kết đơn trong phân tử là hydrocarbon no.
Lời giải:
Đáp án đúng là: B
Hydrocarbon chỉ có liên kết đơn trong phân tử là hydrocarbon no.
Bài 12.2 trang 38 SBT Hóa học 11: Phát biểu nào sau đây về alkane là không đúng?
A. Trong phân tử alkane chỉ có liên kết đơn.
B. Chỉ các alkane là chất khí ở điều kiện thường được dùng làm nhiên liệu.
C. Các alkane lỏng được dùng sản xuất xăng, dầu và làm dung môi.
D. Các alkane rắn được dùng làm nhựa đường, nguyên liệu cho quá trình cracking.
E. Công thức chung của alkane là CxH2x+2, với x ≥ 1.
Lời giải:
Đáp án đúng là: B
Một số alkane lỏng, rắn cũng có thể được sử dụng làm nhiên liệu.
Bài 12.3 trang 38 SBT Hóa học 11: Số đồng phân cấu tạo ứng với công thức phân tử C6H14 là
A. 3. B. 5. C. 4. D. 6.
Lời giải:
Đáp án đúng là: B
5 đồng phân của C6H14 là
A. 2,2-dimethylpentane. B. 2,3-dimethylpentane.
C. 2,2,3-trimethylbutane. D. 2,2-dimethylbutane.
Lời giải:
Đáp án đúng là: A
(CH3)3CCH2CH2CH3: 2,2-dimethylpentane.
(a) Phân tử khối. (b) Tương tác van der Waals giữa các phân tử.
(c) Độ tan trong nước. (d) Liên kết hydrogen giữa các phân tử.
Lời giải:
Đáp án đúng là: (c), (d).
Do không có liên kết hydrogen hình thành giữa các phân tử alkane nên độ tan trong nước và liên kết hydrogen không ảnh hưởng đến nhiệt độ sôi các alkane.
A. 3. B. 4. C. 2. D. 5.
Lời giải:
Đáp án đúng là: C
2 alkene đồng phân cấu tạo của nhau là: 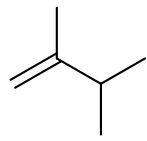
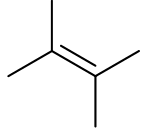
A. Ethane. B. Propane. C. Pentane. D. Butane.
Lời giải:
Đáp án đúng là: A
Nhiệt lượng khi đốt cháy 1 gam các hydrocarbon lần lượt là
Ethane:
Propane:
Butane:
Pentane:
Vậy ethane tỏa ra nhiều nhiệt lượng nhất.
A. trong ống nghiệm có chất lỏng đồng nhất.
B. màu của nước bromine bị mất.
C. màu của bromine không thay đổi.
D. trong ống nghiệm xuất hiện kết tủa.
Lời giải:
Đáp án đúng là: B
Do xảy ra phản ứng thế của hexane với bromine nên màu của nước bromine bị mất.
A. 3. B. 4. C. 5. D. 6.
Lời giải:
Đáp án đúng là: B
Bromine có thể thế vào 4 vị trí của hydrocarbon Y như đánh số sau:
Vậy sẽ có 4 dẫn xuất monobromo là đồng phân cấu tạo của nhau.
A. CH4. B. C2H4. C. C2H6. D. C6H6.
Lời giải:
Đáp án đúng là: A
Gọi công thức của hydrocarbon X là CxHy. Ta có:
x : y = = 6.25 : 25 = 1 : 4
Vậy công thức phân tử của X là CH4.
Bài 12.11 trang 39 SBT Hóa học 11: Cho butane phản ứng với chlorine thu được sản phẩm chính là
A. 2-chlorobutane. B. 1-chlorobutane.
C. 3-chlorobutane. D. 4-chlorobutane.
Lời giải:
Đáp án đúng là: A
Trong phản ứng thế halogen, nguyên tử H ở carbon bậc cao hơn dễ bị thế bởi nguyên tử halogen hơn so với nguyên tử H ở carbon bậc thấp.
A. Thực hiện phản ứng reforming để thay đổi cấu trúc của các alkane mạch không nhánh thành hydrocarbon mạch nhánh hoặc mạch vòng có chỉ số octane cao.
B. Thực hiện phản ứng cracking để thay đổi cấu trúc các alkane mạch dài chuyển thành các alkene và alkane mạch ngắn hơn.
C. Thực hiện phản ứng hydrogen hoá để chuyển các alkene thành alkane.
D. Bổ sung thêm heptane vào xăng, dầu.
Lời giải:
Đáp án đúng là: A
Phản ứng reforming tạo nhiều hydrocarbon mạch nhánh, làm tăng chỉ số octane của xăng, dầu. Xăng, dầu có chỉ số octane càng cao thì càng có hiệu suất cháy cao, đồng thời giảm thiểu được ô nhiễm môi trường.
A. Không sử dụng phương tiện giao thông.
B. Cấm các phương tiện giao thông tại các đô thị.
C. Sử dụng phương tiện chạy bằng điện hoặc nhiên liệu xanh.
D. Sử dụng các phương tiện chạy bằng than đá.
Lời giải:
Đáp án đúng là: C
Sử dụng phương tiện chạy bằng điện hoặc nhiên liệu xanh.
Bài 12.14 trang 40 SBT Hóa học 11: Trong công nghiệp, các alkane được điều chế từ nguồn nào sau đây?
A. Sodium acetate. B. Dầu mỏ và khí mỏ dầu.
C. Aluminium carbide (Al4C3). D. Khí biogas.
Lời giải:
Đáp án đúng là: B
Alkane dùng trong công nghiệp được lấy từ nguồn alkane có trong tự nhiên, bao gồm dầu mỏ, khí thiên nhiên và khí mỏ dầu.
Lời giải:
Do tính phản ứng chọn lọc của bromine nên sản phẩm chính là chất có nguyên tử Br ở nguyên tử carbon có bậc cao nhất: (CH3)2CBrCH2CH3.
Lời giải:
Các hợp chất có thể thu được là:
CH2=C(CH3)CH2CH3, (CH3)2C=CHCH3, (CH3)2CHCH=CH2.
a) Các sự cố tràn dầu trên biển gây ra các thảm hoạ về môi trường như thế nào?
b) Để xử lí sự cố tràn dầu trên biển, người ta thường làm như thế nào?
Giải thích lí do sử dụng các kĩ thuật đó.
Lời giải:
a) Dầu nhẹ hơn nước, không tan trong nước, bị loang ra nên che phủ bề mặt biển làm giảm khả năng hoà tan của oxygen trong không khí vào trong nước biển, làm cho các sinh vật biển bị chết…
b)
Để xử lí sự cố tràn dầu trên biển, người ta thường:
- Dùng các phao để gom dầu; việc dùng vật liệu hấp phụ dầu hiện đang nghiên cứu triển khai.
- Hút dầu vào các bể chứa (lẫn nước biển).
- Chiết tách để loại bỏ nước, thu lấy dầu.
Lời giải:
Phương án 1. Khai thác như khai thác than: đào mỏ; lấy các cục băng cháy, làm tan chảy thu lấy khí methane.
Phương án 2. Như kĩ thuật hiện đại khai thác sulfur: làm tan chảy băng cháy dưới lòng đất, thu khí bay lên.
Lời giải:
Nếu chỉ dùng một loại hydrocarbon thì nhiệt giải phóng ra không đủ để khởi động động cơ. Và việc lưu trữ để đủ lượng xăng cho ô tô, xe máy sẽ khó khăn hơn (bình rất to hoặc phải là bình chịu áp suất cao).
|
Chất |
Nhiệt lượng (kJ mol−1) |
Chất |
Nhiệt lượng (kJ mol−1) |
|
methane |
783 |
propane |
2 220 |
|
ethane |
1 570 |
butane |
2 875 |
a) Khi đốt 1 gam chất nào sẽ giải phóng ra lượng nhiệt lớn nhất?
b) Để đun sôi cùng một lượng nước từ cùng nhiệt độ ban đầu, với giả thiết các điều kiện khác là như nhau, cần đốt cháy khối lượng chất nào là ít nhất?
Lời giải:
a) Tính lượng nhiệt tỏa ra khi đốt cháy 1 gam chất.
|
Chất |
Nhiệt lượng (kJ mol−1) |
Nhiệt lượng/gam (kJ mol−1g−1) |
Chất |
Nhiệt lượng (kJ mol−1) |
Nhiệt lượng/gam (kJ mol−1g−1) |
|
methane |
783 |
48,94 |
propane |
2 220 |
50,45 |
|
ethane |
1 570 |
52,33 |
butane |
2 875 |
46,57 |
Như vậy, khi đốt cháy 1 gam mỗi chất trên, ethane sẽ sinh ra lượng nhiệt lớn nhất.
b) Từ kết quả phần a), ta thấy khối lượng chất cần đốt cháy ít nhất là ethane.
Lời giải:
Trong 1 lít khí gas có 0,4 lít propane (số mol = 0,0161 mol) và 0,6 lít butane (số mol = 0,0242).
Lượng nhiệt toả ra tương ứng:
0,0161.2 220 + 0,0242.2 875 = 35,742 + 69,575 = 105,317 (kJ).
Lời giải:
Khi phát hiện rò rỉ khí gas trong nhà, chúng ta cần:
- Làm thoáng không khí trong phòng bằng cách mở cửa.
- Không được bật các thiết bị điện như quạt, đèn,…
- Kiểm tra khoá bình gas, khoá lại nếu do quên chưa khóa.
- Báo cho nhà cung cấp gas để sửa chữa, thay thế nếu do van bị hỏng hoặc ống dẫn gas bị hở (do lâu ngày nên bị nứt, do chuột cắn,…).
Lời giải:
Do các phương tiện giao thông đốt cháy nhiên liệu sinh ra nhiều khí carbon dioxide, các nitrogen oxide, carbon monoxide và các hạt bụi mịn do xăng, dầu cháy không hoàn toàn… nên có thể nói “Các phương tiện giao thông là một trong các nguyên nhân chính gây ra ô nhiễm môi trường ở các đô thị lớn”.
Xem thêm các bài giải SBT Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Bài 11: Cấu tạo hoá học của hợp chất hữu cơ
Lý thuyết Alkane
1. Khái niệm về Alkane
a. Tìm hiểu nguồn Alkane trong tự nhiên
- Bề mặt những vùng đầm lầy thường xuất hiện các bong bóng khí, đó là alkane đơn giản nhất
- Có tên gọi methane
- Dấu mỏ trong tự nhiên cũng chứa thành phần chính là các alkane.
b. Tìm hiểu cấu tạo và công thức chung của alkane
- Alkane không phân nhánh có mạch carbon chứa nguyên tử carbon bậc I và bậc II
- Alkane phân nhánh có chứa nguyên tử carbon bạc III, bậc IV.
=> Alkane là những hydrocarbon mạch hở, chứa liên kết đơn
- Có công thức chung: CnH2n+2 (n ≥ 1)
2. Danh pháp Alkane
- Tên theo danh pháp của alkane không phân nhánh:
![]()
- Tên theo danh pháp của alkane phân nhánh:
![]()
+ Chọn mạch chính là mạch carbon dài nhất
+ Tên nhánh là tên gốc alkyl
3. Tính chất vật lí
- Ở điều kiện thường, các alkane từ C1 đến C4 và neopentan ở thể khí
- Các alkane có nhiều nguyên tử carbon hơn ở thể lỏng hoặc rắn.
- Các alkane đều nhẹ hơn nước.
- Do các phân tử alkane không phân cực nên alkane không tan trong nước nhưng tan tốt trong các dung môi không phân cực.
4. Tính chất hóa học
a. Tìm hiểu đặc điểm liên kết hóa học trong phân tử alkane
- Mỗi nguyên tử carbon trong alkane đều nằm ở tâm của một tứ diện
- alkane tương đối trơ về mặt hóa học
b. Tìm hiểu tính chất hóa học của alkane
* Phản ứng thế Halogen
- Nguyên tử hydrogen liên kết với nguyên tử carbon bậc cao hơn, dễ vị thế bởi nguyên tử halogen so với nguyên tử hydrogen
- Các sản phẩm thế halogen của hydrocarbon được gọi là dẫn xuất halogen của hydrocarbon
Ví dụ:
C6H14 + Cl2 ―1:1, ánh sáng→ C6H13Cl + HCl
* Phản ứng Cacking
- Cracking alkane là quá trình “bẻ gãy” các phân tử alkane mạch dài thành cá phân tuwe hydrocarbon mạch ngắn hơn
Ví dụ:
C12H26 → C7H16 + C5H10
* Phản ứng reforming
- Là quá trình biến đổi cấu trúc phân tử các alkane mạch không phân nhánh, mạch hở, không thơm thành các hydrocarbon có mạch nhánh hoặc mạch vòng
* Phản ứng oxi hóa
- Oxi hóa hoàn toàn: các alkane thường dễ cháy và tỏa nhiệt nhiều nên nhiều alkane được dùng làm nhiên liệu
- Oxi hóa không hoàn toàn: Thiếu oxygen phản ứng cháy xảy ra không hoàn toàn → gây ô nhiễm môi trường
+ Alkane không làm mất màu dung dịch KMNO4
5. Ứng dụng của alkane và điều chế alkane trong công nghiệp
a. Tìm hiểu ứng dụng của alkane
- Alkane dùng làm nhiên liệu, dung môi, dầu nhờn,… và là nguyên liệu trong tổng hợp hữu cơ
b. Tìm hiểu điều chế alkane trong công nghiệp
- Alkane là thành phần chính của khí nhiên nhiêm, khí đồng hành và dầu mỏ
+ Từ khí thiên nhiên thu được: CH4, C2H6,…
+ Từ dầu mỏ bằng phương pháp chưng cất
c. Tìm hiểu một số nguyên nhân gây ô nhiễm không khí do các phương tiện giao thông, cách giảm thiểu và hạn chế
- Ô nhiễm không khí là một trong các nguyên nhân góp phần làm Trải Đất nóng lên và gây ra sự biến đổi khí hậu toàn cầu:
+ Khí thải do các phương tiện giao thông hoạt động thải ra
+ Khói thải và các hạt bụi mịn thải vào khí quyền là tác nhân gây ảnh hưởng nghiêm trọng đến sức khoẻ người dân.
- Biện pháp
+ Tăng cường hình thức vận tải công cộng
+ Giảm thiểu sự phụ thuộc nhiên liệu hoá thạch, tăng cường các nguồn nhiên liệu xanh, sạch như hydrogen, năng lượng mặt trời
+ Bảo vệ rừng
=> Là những cách giúp hạn chế sự ô nhiễm không khí