Với lời giải SBT Hóa học 11 trang 31 chi tiết trong Bài 9: Phương pháp tách biệt và tinh chế hợp chất hữu cơ Cánh diều giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 9: Phương pháp tách biệt và tinh chế hợp chất hữu cơ
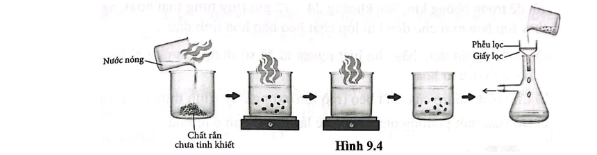
Bài 9.11 trang 31 SBT Hóa học 11: Một học sinh tiến hành kết tinh lại để tinh chế một chất hữu cơ rắn có nhiễm chất bẩn và vẽ lại quá trình tiến hành như ở Hình 9.4.
a) Mô tả quá trình kết tinh lại mà học sinh trên đã thực hiện.
b) Giải thích vì sao sau khi kết tinh lại thì chất rắn ban đầu lại sạch hơn.
Lời giải:
a) Thêm dần nước nóng vào cốc chứa chất rắn chưa tinh khiết đến khi chất rắn tan hoàn toàn. Để nguội dung dịch để tạo thành tinh thể. Lọc lấy tinh thể chất rắn bằng phễu lọc có lót giấy lọc.
b) Sau khi kết tinh lại, một số chất bẩn tan vào dung dịch. Do nồng độ chất bẩn chưa đạt đến nồng độ quá bão hoà nên chất bẩn không kết tinh lại và bị lọc bỏ khỏi chất rắn kết tinh. Vì thế, chất rắn ban đầu trở nên sạch hơn.
Bài 9.12 trang 31 SBT Hóa học 11: Benzene thương mại (ts = 80,1°C) thu được từ quá trình chưng cất nhựa than đá chứa 3 − 5% thiophene (ts = 84,2°C). Thiophene được loại khỏi benzene bằng cách chiết với dung dịch sulfuric acid đậm đặc. Quá trình tinh chế này dựa trên cơ sở là phản ứng giữa sulfuric acid với thiophene xảy ra dễ dàng hơn nhiều so với benzene. Khi lắc benzene thương mại với dung dịch sulfuric acid đậm đặc, chỉ thiophene phản ứng với sulfuric acid để tạo thành thiophene-2-sulfonic acid tan trong sulfuric acid. Chiết lấy lớp benzene, rửa nhiều lần bằng nước rồi làm khô bằng CuSO4 khan và đem chưng cất thu lấy benzene tinh khiết.
a) Benzene thương mại lẫn tạp chất gì? Vì sao không tiến hành chưng cất ngay benzene thương mại để thu lấy benzene tinh khiết?
b) Vì sao sau khi xử lí benzene thương mại với dung dịch sulfuric acid đậm đặc thì loại bỏ được tạp chất?
c) Vì sao sau khi xử lí benzene thương mại với dung dịch sulfuric acid đậm đặc lại phải rửa benzene nhiều lần với nước?
d) Nước lẫn trong benzene được loại bỏ bằng cách nào? Dự đoán hiện tượng xảy ra và cho biết làm sao để biết nước đã không còn trong benzene sau khi được xử lí.
Lời giải:
a) Tạp chất có lẫn trong benzene thương mại là thiophene. Không chưng cất ngay benzene thương mại vì thiophene có nhiệt độ sôi không chênh lệch quá nhiều với benzene nên khi đun nóng cả 2 chất sẽ cùng bị bay hơi (ts = 84,2°C) và (ts = 80,1°C).
b) Do thiophene trong benzene thương mại phản ứng với dung dịch sulfuric acid đậm đặc, tạo thành thiophene-2-sulfonic acid tan trong sulfuric acid còn benzene không tan trong dung dịch sulfuric acid đậm đặc nên loại bỏ được thiophene bằng phương pháp chiết.
c) Sau khi xử lí benzene thương mại với dung dịch sulfuric acid đậm đặc phải rửa benzene nhiều lần với nước để loại bỏ lượng nhỏ sulfuric acid còn lẫn trong benzene.
d) Nước lẫn trong benzene được loại bỏ bằng cách cho qua CuSO4 khan để trong hút nước. CuSO4 khan có màu trắng, khi hút nước tạo CuSO4.5H2O có màu xanh. Khi CuSO4 khan không còn chuyển sang màu xanh thì không còn nước trong benzene.
Bài 9.13 trang 31 SBT Hóa học 11: Một mẫu hoa hoè được xác định có hàm lượng rutin là 26%. Người ta đun sôi hoa hoè với nước (100 °C) để chiết lấy rutin. Biết độ tan của rutin là 5,2 gam trong 1 lít nước ở 100 °C và là 0,125 gam trong 1 lít nước ở 25 °C.
a) Cần dùng thể tích nước tối thiểu là bao nhiêu để chiết được lượng rutin có trong 100 gam hoa hoè?
b) Giả thiết rằng toàn bộ lượng rutin trong hoa hoè đã tan vào nước khi chiết. Làm nguội dung dịch chiết 100 gam hoa hoè ở trên từ 100°C xuống 25°C thì thu được bao nhiêu gam rutin kết tinh?
c) Vì sao khi sử dụng lượng nước lớn hơn thì khối lượng rutin thu được khi kết tinh lại giảm đi?
Lời giải:
a) Khối lượng rutin trong 100g hoa hòe là: 100.26% = 26 g
Thể tích nước cần dùng để hoà tan hết lượng rutin ở 100 °C là: 26 : 5,22 = 5 (lít)
b) 5 lít nước ở 25 °C chứa 5.0,125 = 0,625 (g) rutin.
Lượng rutin thu được khi để kết tinh là: 26 – 0,625 = 25,375 (g).
c) Do khi lượng nước tăng lên, lượng rutin được hòa tan ở 25oC sẽ tăn theo, lượng rutin kết tinh sẽ giảm đi.
Xem thêm lời giải Sách bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Bài 9.1 trang 28 SBT Hóa học 11: Một học sinh tiến hành chưng cất để tách CHCl3 (ts = 61 °C) ra khỏi CHCl2CHCl2 (ts = 146 °C) bằng bộ dụng cụ như ở Hình 9.1.Khi bắt đầu thu nhận CHCl3 vào bình hứng thì nhiệt độ tại vị trí nào trong hình đang là 61 °C?...
Bài 9.2 trang 29 SBT Hóa học 11: Hỗn hợp X gồm các alkane: pentane (ts = 36,1 °C), heptane (ts = 98,4 °C), octane (ts = 125,7 °C) và nonane (ts = 150,8 °C). Có thể tách riêng các chất đó một cách thuận lợi bằng phương pháp nào sau đây?...
Bài 9.3 trang 29 SBT Hóa học 11: Tính chất vật lí nào sau đây được quan tâm khi tách hai chất lỏng tan vào nhau bằng phương pháp chưng cất?...
Bài 9.4 trang 29 SBT Hóa học 11: Việc tách các chất ra khỏi nhau bằng phương pháp sắc kí dựa trên đặc tính nào sau đây của chất?...
Bài 9.5 trang 29 SBT Hóa học 11: Sử dụng phương pháp kết tinh lại để tinh chế chất rắn. Hợp chất cần kết tinh lại cần có tính chất nào dưới đây để việc kết tinh lại được thuận lợi?...
Bài 9.6 trang 29 SBT Hóa học 11: Ngâm củ nghệ với ethanol nóng, sau đó lọc bỏ phần bã, lấy dung dịch đem cô để làm bay hơi bớt dung môi. Phần dung dịch còn lại sau khi cô được làm lạnh, để yên một thời gian rồi lọc lấy kết tủa curcumin màu vàng. Từ mô tả ở trên, hãy cho biết, người ta đã sử dụng các kĩ thuật tinh chế nào để lấy được curcumin từ củ nghệ...
Bài 9.7 trang 29 SBT Hóa học 11: Pent-1-ene và dipentyl ether đồng thời được sinh ra khi đun nóng pentan-1-ol với dung dịch H2SO4 đặc. Biết rằng nhiệt độ sôi của pentan-1-ol, pent-1-ene và dipentyl ether lần lượt là 137,80C, 30,00C và 186,80C. Từ hỗn hợp phản ứng, các chất được tách khỏi nhau bằng phương pháp chưng cất. Các phân đoạn thu được (theo thứ tự từ trước đến sau) trong quá trình chưng cất lần lượt là...
Bài 9.8 trang 30 SBT Hóa học 11: Vì sao phải cô lập và tinh chế các hợp chất hoá học? Kể tên một số phương pháp về việc áp dụng các phương pháp này để tinh chế chất hoá học trong đời sống. Tìm hiểu và nêu ví dụ minh hoạ được dùng tinh chế chất hữu cơ mà em biết...
Bài 9.9 trang 30 SBT Hóa học 11: Thêm hexane (một hydrocarbon trong phân tử có 6 nguyên tử carbon) vào dung dịch iodine trong nước, lắc đều rồi để yên. Sau đó thu lấy lớp hữu cơ, làm bay hơi dung môi để thu lấy iodine...
Bài 9.10 trang 30 SBT Hóa học 11: Để tinh chế chất hữu cơ rắn chứa tạp chất, người ta hoà tan chất rắn trong dung môi thích hợp rồi lọc bỏ tạp chất không tan (Hình 9.3)...
Bài 9.11 trang 31 SBT Hóa học 11: Một học sinh tiến hành kết tinh lại để tinh chế một chất hữu cơ rắn có nhiễm chất bẩn và vẽ lại quá trình tiến hành như ở Hình 9.4...
Bài 9.12 trang 31 SBT Hóa học 11: Benzene thương mại (ts = 80,1°C) thu được từ quá trình chưng cất nhựa than đá chứa 3 − 5% thiophene (ts = 84,2°C). Thiophene được loại khỏi benzene bằng cách chiết với dung dịch sulfuric acid đậm đặc. Quá trình tinh chế này dựa trên cơ sở là phản ứng giữa sulfuric acid với thiophene xảy ra dễ dàng hơn nhiều so với benzene. Khi lắc benzene thương mại với dung dịch sulfuric acid đậm đặc, chỉ thiophene phản ứng với sulfuric acid để tạo thành thiophene-2-sulfonic acid tan trong sulfuric acid. Chiết lấy lớp benzene, rửa nhiều lần bằng nước rồi làm khô bằng CuSO4 khan và đem chưng cất thu lấy benzene tinh khiết...
Bài 9.13 trang 31 SBT Hóa học 11: Một mẫu hoa hoè được xác định có hàm lượng rutin là 26%. Người ta đun sôi hoa hoè với nước (100 °C) để chiết lấy rutin. Biết độ tan của rutin là 5,2 gam trong 1 lít nước ở 100 °C và là 0,125 gam trong 1 lít nước ở 25 °C...
Bài 9.14 trang 32 SBT Hóa học 11: Chuẩn bị các khuôn gỗ có kích thước 58 cm × 80 cm × 5 cm, ở giữa có đặt tấm thuỷ tinh được quét mỡ lợn cả hai mặt, mỗi lớp dày 3 mm. Đặt lên trên bề mặt chất béo một lớp lụa mỏng rồi rải lên trên 30 – 80 g hoa tươi khô ráo, không bị dập nát. Khoảng 30 – 40 khuôn gỗ được xếp chồng lên nhau rồi để trong phòng kín. Sau khoảng 24 – 72 giờ (tuỳ từng loại hoa), người ta thay lớp hoa mới cho đến khi lớp chất béo bão hoà tinh dầu...
Xem thêm các bài giải SBT Hóa học lớp 11 Cánh diều hay, chi tiết khác:
