Với giải Bài 3.20 trang 9 SBT Hóa học lớp 10 Kết nối tri thức chi tiết trong Bài 3: Cấu trúc lớp vỏ electron nguyên tử giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 10. Mời các bạn đón xem:
Giải sách bài tập Hóa học lớp 10 Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Bài 3.20 trang 9 SBT Hóa học 10: Trường hợp trong orbital p có chứa hai electron thì có những cách nào biểu diễn electron trong orbital đó? Cách nào tuân theo quy tắc Hund?
Lời giải:
Trường hợp orbital p có chứa 2 electron, có rất nhiều cách để biểu diễn 2 electron trong AOp. Ví dụ một số cách:
Tuy có nhiều cách biểu diễn nhưng chỉ có trường hợp (2) tuân theo quy tắc Hund (số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau).
Chú ý: Theo nguyên lí Pauli: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau. Nếu orbital có 1 electron thì biểu diễn bằng 1 mũi tên đi lên (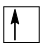
)
Xem thêm các bài giải sách bài tập Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 3.1 trang 7 SBT Hóa học 10: Orbital nguyên tử là...
Bài 3.4 trang 8 SBT Hóa học 10: Sự phân bố electron vào các lớp và phân lớp căn cứ vào...
Bài 3.8 trang 8 SBT Hóa học 10: Phát biểu nào sau đây đúng?...
Bài 3.9 trang 8 SBT Hóa học 10: Mỗi orbital nguyên tử chứa tối đa...
Bài 3.10 trang 8 SBT Hóa học 10: Số orbital trong các phân lớp s, p, d lần lượt bằng...
Bài 3.12 trang 9 SBT Hóa học 10: Lớp L có số phân lớp electron bằng...
Bài 3.13 trang 9 SBT Hóa học 10: Lớp M có số orbital tối đa bằng...
Bài 3.14 trang 9 SBT Hóa học 10: Lớp M có số electron tối đa bằng...
Bài 3.18 trang 9 SBT Hóa học 10: Sự phân bố electron theo ô orbital nào dưới đây là đúng?...
Bài 3.19 trang 9 SBT Hóa học 10: Dùng ô orbital để mô tả cách sắp xếp electron trong orbital s...
Bài 3.22 trang 9 SBT Hóa học 10: Cho biết tổng số electron tối đa chứa trong:...
Bài 3.23 trang 10 SBT Hóa học 10: Nguyên tố X có Z = 12 và nguyên tố Y có Z = 17...
Bài 3.24 trang 10 SBT Hóa học 10: Viết cấu hình...
Xem thêm các bài giải SBT Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một nhóm