Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh đang trong quá trình ôn tập tài liệu Lý thuyết, bài tập về Benzen có đáp án môn Hóa học lớp 9, tài liệu bao gồm 6 trang, đầy đủ lý thuyết, phương pháp giải chi tiết và bài tập có đáp án (có lời giải), giúp các em học sinh có thêm tài liệu tham khảo trong quá trình ôn tập, củng cố kiến thức và chuẩn bị cho bài thi môn Hóa học sắp tới. Chúc các em học sinh ôn tập thật hiệu quả và đạt được kết quả như mong đợi.
Mời các quý thầy cô và các em học sinh cùng tham khảo và tải về chi tiết tài liệu dưới đây:
Hóa học 9 Bài 39: Benzen
A. Lý thuyết Benzen
- Công thức phân tử C6H6
– Phân tử khối 78
I. Tính chất vật lý
– Benzen C6H6 là chất lỏng, không màu, không tan trong nước, nhẹ hơn nước.
– Benzen hòa tan nhiều chất như: dầu ăn, cao su, nến, iot,…
– Benzen độc.
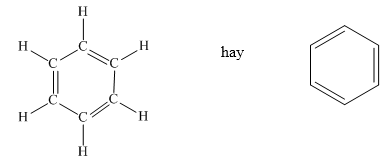
II. Cấu tạo phân tử
Từ công thức cấu tạo của benzen, ta thấy sáu nguyên tử cacbon liên kết với nhau tạo thành vòng sáu cạnh đều, có ba liên kết đôi xen kẽ ba liên kết đơn.
III. Tính chất hóa học
1. Tác dụng với oxi
– Khi đốt benzen cháy trong không khí tạo ra CO2 và H2O, ngọn lửa có nhiều khói đen (muội than)
C6H6 + O2 → 6CO2 + 3H2O
– Muội than sinh ra là do trong không khí không cung cấp đủ oxi để đốt cháy hoàn toàn C6H6
2. Phản ứng thế với với brom
– Benzen không làm mất màu dung dịch brom như etilen và axetilen. Nó chỉ tham gia phản ứng thế với brom lỏng và cần có xúc tác là bột sắt.
C6H6 + Br2 → HBr + C6H5Br (brombenzen)
Benzen chỉ phản ứng với brom nguyên chất, không phản ứng với dung dịch nước brom hay benzen không làm mất màu dung dịch brom ở điều kiện thường.
3. Phản ứng cộng:
– Benzen khó tham gia phản ứng cộng hơn etilen và axetilen. Tuy nhiên, trong điều kiện thích hợp benzen có phản ứng cộng với một số chất như H2, Cl2,…
C6H6 + 3H2 → C6H12
C6H6 + 3Cl2 → C6H6Cl6
(Hexacloxiclohexan) Thuốc trừ sâu 6,6,6
– Do phân tử có cấu tạo đặc biệt nên benzen vừa có phản ứng thế, vừa có phản ứng cộng. Tuy nhiên phản ứng cộng của benzen xảy ra khó hơn etilen và axetilen.
IV. Ứng dụng
– Benzen là nguyên liệu quan trọng để sản xuất chất dẻo, phẩm nhuộm, dược phẩm, thuốc trừ sâu..
– Benzen làm dung môi hòa tan nhiều chất hữu cơ trong công nghiệp và trong phòng thí nghiệm.
B. Trắc nghiệm Benzen
Câu 1: Benzen có tính chất:
A. Dễ tham gia phản ứng thế, khó tham gia phản ứng cộng và bền với các chất oxi hóa
B. Khó tham gia phản ứng thế, dễ tham gia phản ứng cộng
C. Khó thế, khó cộng và bền với các chất oxi hóa
D. Dễ thế, dễ cộng và bền với các chất oxi hóa
Câu 2: Dãy đồng đẳng của benzen có công thức chung là: C6H6
A. CnH2n+2 B. CnH2n−2 C. CnH2n−4 D. CnH2n−6
Câu 3: Benzen tác dụng với Cl2 có ánh sáng, thu được hexancloran. Công thức của hexancloran là
A. C6H6Cl2 B. C6H6Cl6 C. C6H5Cl D.C6Cl6
Câu 4: Benzen là hợp chất hidrocacbon thơm có cấu tạo đơn giản nhất . Trong thực tế benzen được dùng để:
A. Làm dung môi
B. Tổng hợp polime, chất dẻo, cao su, tơ, sợi
C. Làm dầu bôi trơn
D. Cả A và B đều đúng
Câu 5: Câu nào sau đây sai khi nói về benzen?
A. Sáu nguyên tử C trong phân tử benzen tạo thành một lúc giác đều
B. Tất cả nguyên tử trong phân tử benzen đều cùng nằm trên một mặt phẳng
C. Trong phân tử benzen, các góc hóa trị bằng 120∘
D. Trong phân tử benzen, liên kết đôi dài hơn liên kết đơn
Câu 6: Phản ứng đặc trưng của benzen là
A. phản ứng cháy.
B. phản ứng cộng với hiđro (có niken xúc tác).
C. phản ứng thế với brom (có bột sắt).
D. phản ứng thế với clo (có ánh sáng).
Câu 7: Trong các hiđrocacbon sau khi đốt hiđrocacbon nào sinh ra nhiều muội than ?
A. C2H6 B. CH4
C. C2H4 D. C6H6
Câu 8: Hỗn hợp C6H6 và Cl2 có tỉ lệ mol 1: 1,5. Trong điều kiện có xúc tác Fe, nhiệt độ, hiệu suất 100%. Sau đó thu được những chất gì? Bao nhiêu mol?
A. 1 mol C6H5Cl; 1 mol HCl; 1 mol C6H4Cl2
B. 1,5 mol C6H5Cl; 1,5 mol HCl; 0,5 mol C6H4Cl2
C. 1 mol C6H5Cl; 1,5 mol HCl; 0,5 mol C6H4Cl2
D. 0,5 mol C6H5Cl; 1,5 mol HCl; 0,5 mol C6H4Cl2
C6H6 + Cl2 → C6H5Cl +HCl
Bđau 1 1,5
Pư 1 1 1 1
Sau pư 0 0,5 1 1
C6H5Cl + Cl2 → C6H4Cl2 + HCl’
Bd 1 0,5
Pư 0,5 0,5 0,5 0,5
Sau pu 0,5 0 0,5 0,5
C6H5Cl 0,5 C6H4Cl20,5 HCl 1,5
Câu 9: Tính chất đặc trưng của benzen là:
A.Chất lỏng, cháy cho ngọn lửa sáng
B.Chất khí, có mùi đặc trưng, không tan trong nước
C.Chất lỏng, có mùi đặc trưng, không tan trong nước
D.Chất rắn, hòa tan tốt trong nước
Câu 10: Ứng dụng của benzen:
A. Sản xuất chất dẻo
B. Nguyên liệu sản xuất phẩm nhuộm, dược phẩm, thuốc trừ sâu..
C. Làm dung môi hòa chất hữu cơ trong công nghiệp và trong phòng thí nghiệm.
D. Cả 3 đáp án trên
Câu 11: Cho benzen + Cl2 (as) ta thu được dẫn xuất clo A. Vậy A là:
A. C6H5Cl. B. p-C6H4Cl2.
C. C6H6Cl6. D. m-C6H4Cl2.
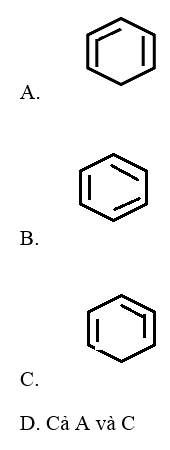
Câu 12: Công thức cấu tạo của benzen nào sau đây là sai?
Câu 13: Đốt cháy hoàn toàn 2,12 gam một hidrocacbon (A) thuộc dãy đồng đẳng của benzen thì thu được 7,04 gam khí CO2. Công thức phân tử của A là:
A. C6H6 B. C7H8 C. C8H10 D. C9H12
CnH2n-6 + O2 → nCO2 + (n-3) H2O
0,16/n 0,16 mol
2,12n = 0,16*14n -0,16*6
n=8