Tailieumoi.vn giới thiệu Giải bài tập Hóa học lớp 9 Bài 39: Benzen chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Benzen lớp 9.
Giải bài tập Hóa học lớp 9 Bài 39: Benzen
Câu hỏi và bài tập ( trang 125 SGK Hóa học 9)
Bài 1 trang 125 SGK Hóa học 9 : Cấu tạo đặc biệt của phân tử benzen là :
a) Phân tử có vòng 6 cạnh.
b) Phân tử có ba liên kết đôi.
c) Phân tử có vòng 6 cạnh chứa ba liên kết đôi xen kẽ ba liên kết đơn.
d) Phân tử có vòng 6 cạnh chứa liên kết đôi và liên kết đơn.
Hãy chọn câu đúng nhất trong các câu trên.
Phương pháp giải:
Nắm được cấu tạo của phân tử benzen.
Lời giải :
Phân tử benzen có vòng 6 cạnh chứa 3 liên kết đôi xen kẽ 3 liên kết đơn.
Đáp án c
Bài 2 trang 125 SGK Hóa học 9 :
Một số học sinh viết công thức cấu tạo của benzen như sau :
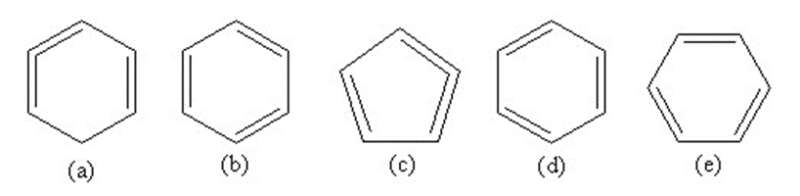
Hãy cho biết công thức nào viết đúng, viết sai. Tại sao ?
Phương pháp giải :
Nắm được đặc điểm cấu tạo của phân tử benzen: vòng 6 cạnh, 3 liên kết đôi xen kẽ 3 liên kết đơn.
Lời giải :
Công thức viết đúng là: b), d), e).
Công thức a) sai vì sai hóa trị của cacbon
Công thức c) sai vì thiếu nguyên tử cacbon và sai hóa trị của cacbon
Bài 3 trang 125 SGK Hóa học 9 : Cho benzen tác dụng với brom tạo ra brombenzen :
a) Viết phương trình hoá học (có ghi rõ điều kiện phản ứng).
b) Tính khối lượng benzen cần dùng để điều chế 15,7 gam brombenzen. Biết hiệu suất phản ứng đạt 80%.
Phương pháp giải :
- Tính được số mol của brombenzen.
- Viết PTHH, đặt mol brombenzen vào PTHH suy ra số mol benzen đã tham gia phản ứng.
- Từ công thức tính hiệu suất:
suy ra số mol benzen ban đầu.
Lời giải:
a) Phương trình hóa học: C6H6 + Br2 C6H5Br + HBr
b) Tính khối lượng benzen: lí thuyết = 15,7 gam
Hiệu suất 80% nên thực tế= (15,7. 100): 80 = 19,625 gam
thực tế = 19,625: 157 = 0,125 mol
Theo PTHH, khối lượng benzen cần là: 0,125 . 78= 9,75 gam
Bài 4 trang 125 SGK Hóa học 9 :
Hãy cho biết chất nào trong các chất sau đây có thể làm mất màu dung dịch brom. Giải thích và viết phương trình hoá học (nếu có).
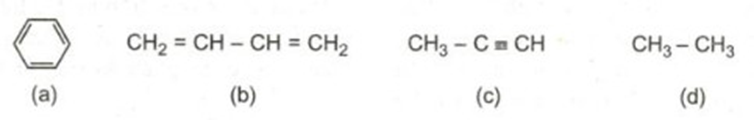
Lời giải:
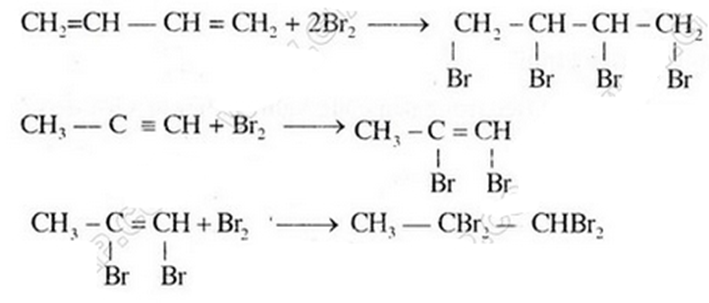
Chỉ có chất b và c làm mất màu dung dịch brom vì trong phân tử có liên kết đôi và liên kết ba tương tự etilen, axetilen.
Các phương trình phản ứng hóa học:
Lý thuyết Bài 39: Bezen
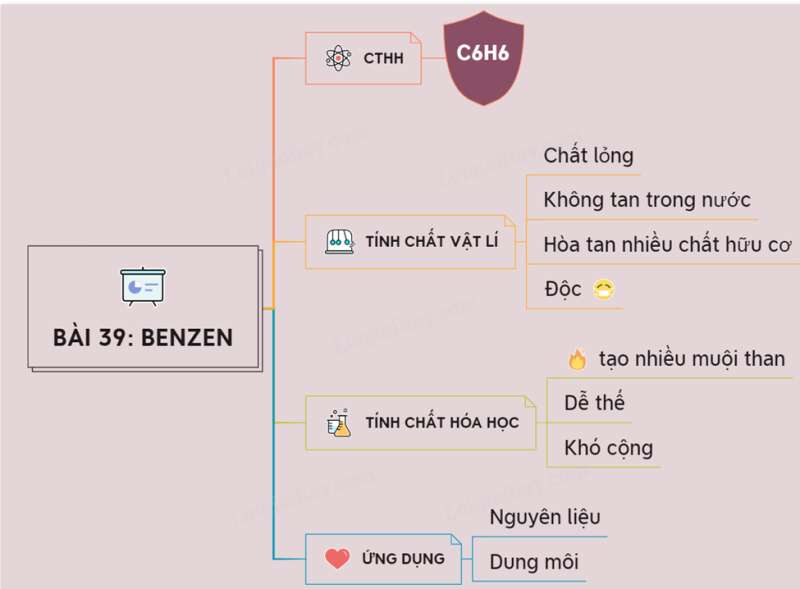
- Công thức phân tử C6H6
- Phân tử khối 78
I. TÍNH CHẤT VẬT LÍ
- Benzen C6H6 là chất lỏng, không màu, không tan trong nước, nhẹ hơn nước
- Benzen hòa tan nhiều chất như: dầu ăn, cao su, nến, iot,...
- Benzen độc
II. CẤU TẠO PHÂN TỬ
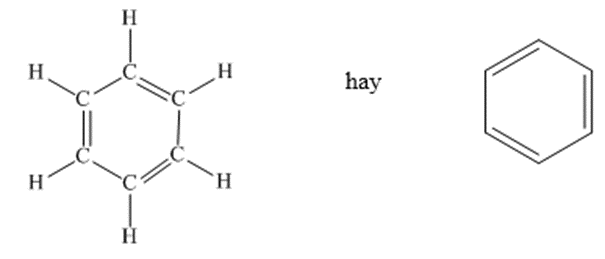
Từ công thức cấu tạo của benzen, ta thấy sáu nguyên tử cacbon liên kết với nhau tạo thành vòng sáu cạnh đều, có ba liên kết đôi xen kẽ ba liên kết đơn.
III. TÍNH CHẤT HÓA HỌC
1. Tác dụng với oxi
- Khi đốt benzen cháy trong không khí tạo ra CO2 và H2O, ngọn lửa có nhiều khói đen (muội than)
C6H6 + O2 6CO2 + 3H2O
- Muội than sinh ra là do trong không khí không cung cấp đủ oxi để đốt cháy hoàn toàn C6H6
2. Phản ứng thế với với brom
- Benzen không làm mất màu dung dịch brom như etilen và axetilen. Nó chỉ tham gia phản ứng thế với brom lỏng và cần có xúc tác là bột sắt.
C6H6 + Br2 HBr + C6H5Br (brombezen)
Benzen chỉ phản ứng với brom nguyên chất, không phản ứng với dung dịch nước brom hay benzen không làm mất màu dung dịch brom ở điều kiện thường.
3. Phản ứng cộng:
- Benzen khó tham gia phản ứng cộng hơn etilen và axetilen. Tuy nhiên, trong điều kiện thích hợp benzen có phản ứng cộng với một số chất như H2, Cl2,…
C6H6 + 3H2 C6H12
C6H6 + 3Cl2 C6H6Cl6
(Hexacloxiclohexan)
Thuốc trừ sâu 6,6,6
- Do phân tử có cấu tạo đặc biệt nên benzen vừa có phản ứng thế, vừa có phản ứng cộng. Tuy nhiên phản ứng cộng của benzen xảy ra khó hơn etilen và axetilen.
IV. ỨNG DỤNG
- Benzen là nguyên liệu quan trọng để sản xuất chất dẻo, phẩm nhuộm, dược phẩm, thuốc trừ sâu..
- Benzen làm dung môi hòa tan nhiều chất hữu cơ trong công nghiệp và trong phòng thí nghiệm.
Sơ đồ tư duy: Benzen