Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh đang trong quá trình ôn tập tài liệu Lý thuyết về nhận biết các hợp chất vô cơ chi tiết môn Hóa học lớp 12, tài liệu bao gồm 24 trang, đầy đủ lý thuyết, phương pháp giải chi tiết và bài tập có đáp án (có lời giải), giúp các em học sinh có thêm tài liệu tham khảo trong quá trình ôn tập, củng cố kiến thức và chuẩn bị cho bài thi tốt nghiệp THPT môn Hóa học sắp tới. Chúc các em học sinh ôn tập thật hiệu quả và đạt được kết quả như mong đợi.
Mời các quý thầy cô và các em học sinh cùng tham khảo và tải về chi tiết tài liệu dưới đây:
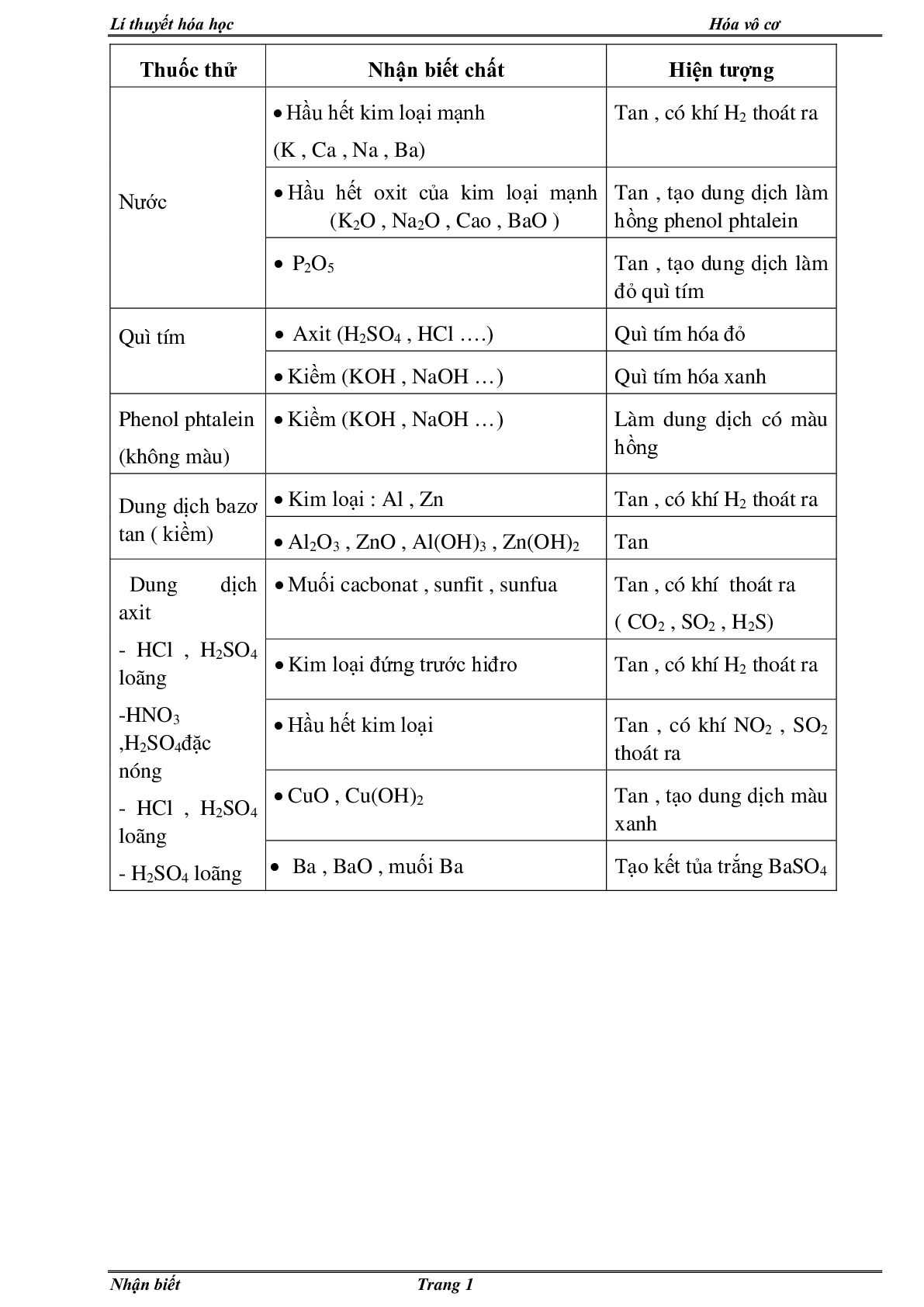
Thuốc thử Nhận biết chất Hiện tượng
Nước • Hầu hết kim loại mạnh
(K , Ca , Na , Ba) Tan , có khí H2 thoát ra
• Hầu hết oxit của kim loại mạnh (K2O , Na2O , Cao , BaO ) Tan , tạo dung dịch làm hồng phenol phtalein
• P2O5 Tan , tạo dung dịch làm đỏ quì tím
Quì tím
• Axit (H2SO4 , HCl ….) Quì tím hóa đỏ
• Kiềm (KOH , NaOH …) Quì tím hóa xanh
Phenol phtalein
(không màu) • Kiềm (KOH , NaOH …) Làm dung dịch có màu hồng
Dung dịch bazơ tan ( kiềm) • Kim loại : Al , Zn Tan , có khí H2 thoát ra
• Al2O3 , ZnO , Al(OH)3 , Zn(OH)2 Tan
Dung dịch axit
- HCl , H2SO4 loãng
-HNO3 ,H2SO4đặc nóng
- HCl , H2SO4 loãng
- H2SO4 loãng • Muối cacbonat , sunfit , sunfua Tan , có khí thoát ra
( CO2 , SO2 , H2S)
• Kim loại đứng trước hiđro Tan , có khí H2 thoát ra
• Hầu hết kim loại Tan , có khí NO2 , SO2 thoát ra
• CuO , Cu(OH)2 Tan , tạo dung dịch màu xanh
• Ba , BaO , muối Ba Tạo kết tủa trắng BaSO4
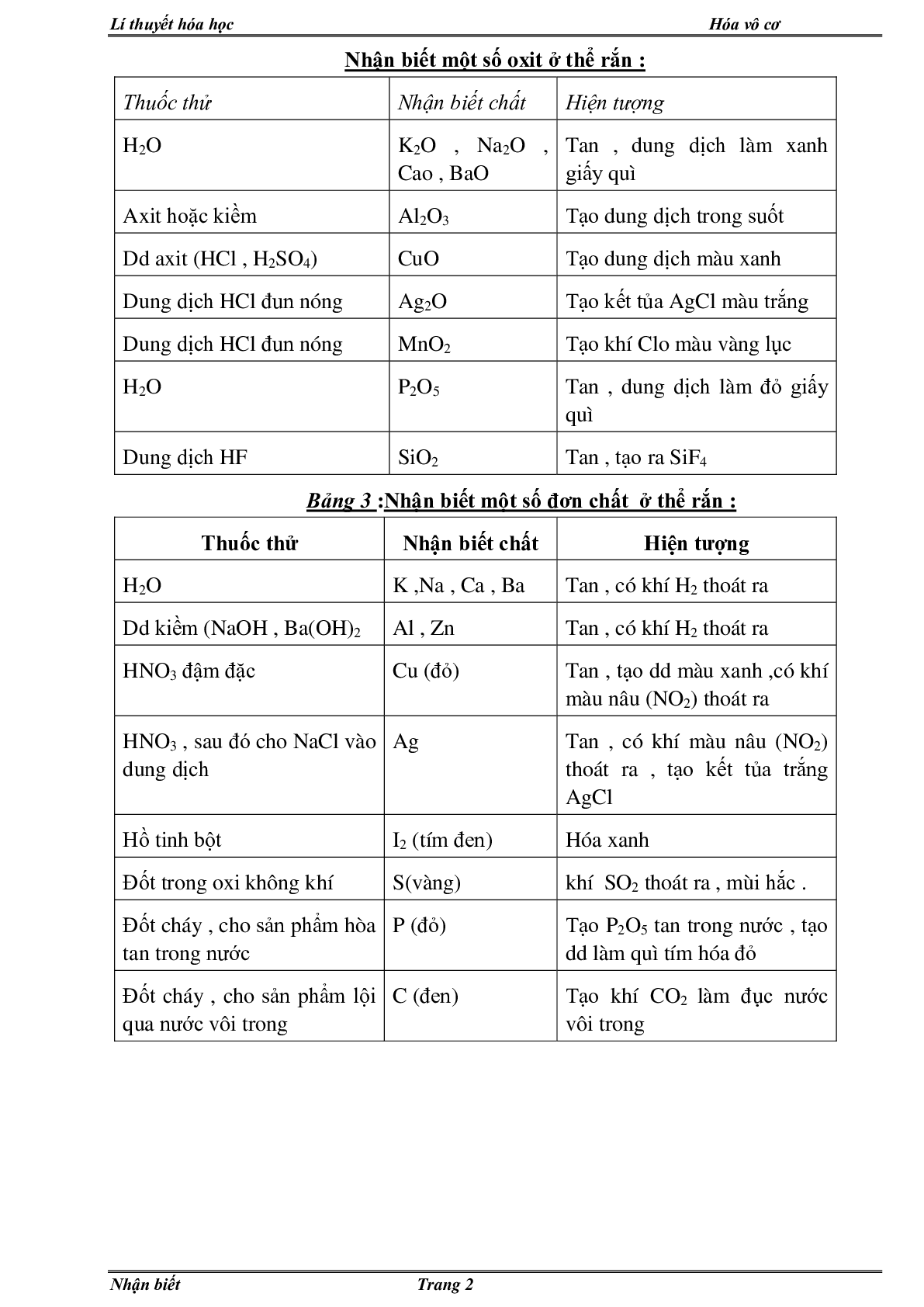
Nhận biết một số oxit ở thể rắn :
Thuốc thử Nhận biết chất Hiện tượng
H2O K2O , Na2O , Cao , BaO Tan , dung dịch làm xanh giấy quì
Axit hoặc kiềm Al2O3 Tạo dung dịch trong suốt
Dd axit (HCl , H2SO4) CuO Tạo dung dịch màu xanh
Dung dịch HCl đun nóng Ag2O Tạo kết tủa AgCl màu trắng
Dung dịch HCl đun nóng MnO2 Tạo khí Clo màu vàng lục
H2O P2O5 Tan , dung dịch làm đỏ giấy quì
Dung dịch HF SiO2 Tan , tạo ra SiF4
Bảng 3 :Nhận biết một số đơn chất ở thể rắn :
Thuốc thử Nhận biết chất Hiện tượng
H2O K ,Na , Ca , Ba Tan , có khí H2 thoát ra
Dd kiềm (NaOH , Ba(OH)2 Al , Zn Tan , có khí H2 thoát ra
HNO3 đậm đặc Cu (đỏ) Tan , tạo dd màu xanh ,có khí màu nâu (NO2) thoát ra
HNO3 , sau đó cho NaCl vào dung dịch Ag Tan , có khí màu nâu (NO2) thoát ra , tạo kết tủa trắng AgCl
Hồ tinh bột I2 (tím đen) Hóa xanh
Đốt trong oxi không khí S(vàng) khí SO2 thoát ra , mùi hắc .
Đốt cháy , cho sản phẩm hòa tan trong nước P (đỏ) Tạo P2O5 tan trong nước , tạo dd làm quì tím hóa đỏ
Đốt cháy , cho sản phẩm lội qua nước vôi trong C (đen) Tạo khí CO2 làm đục nước vôi trong
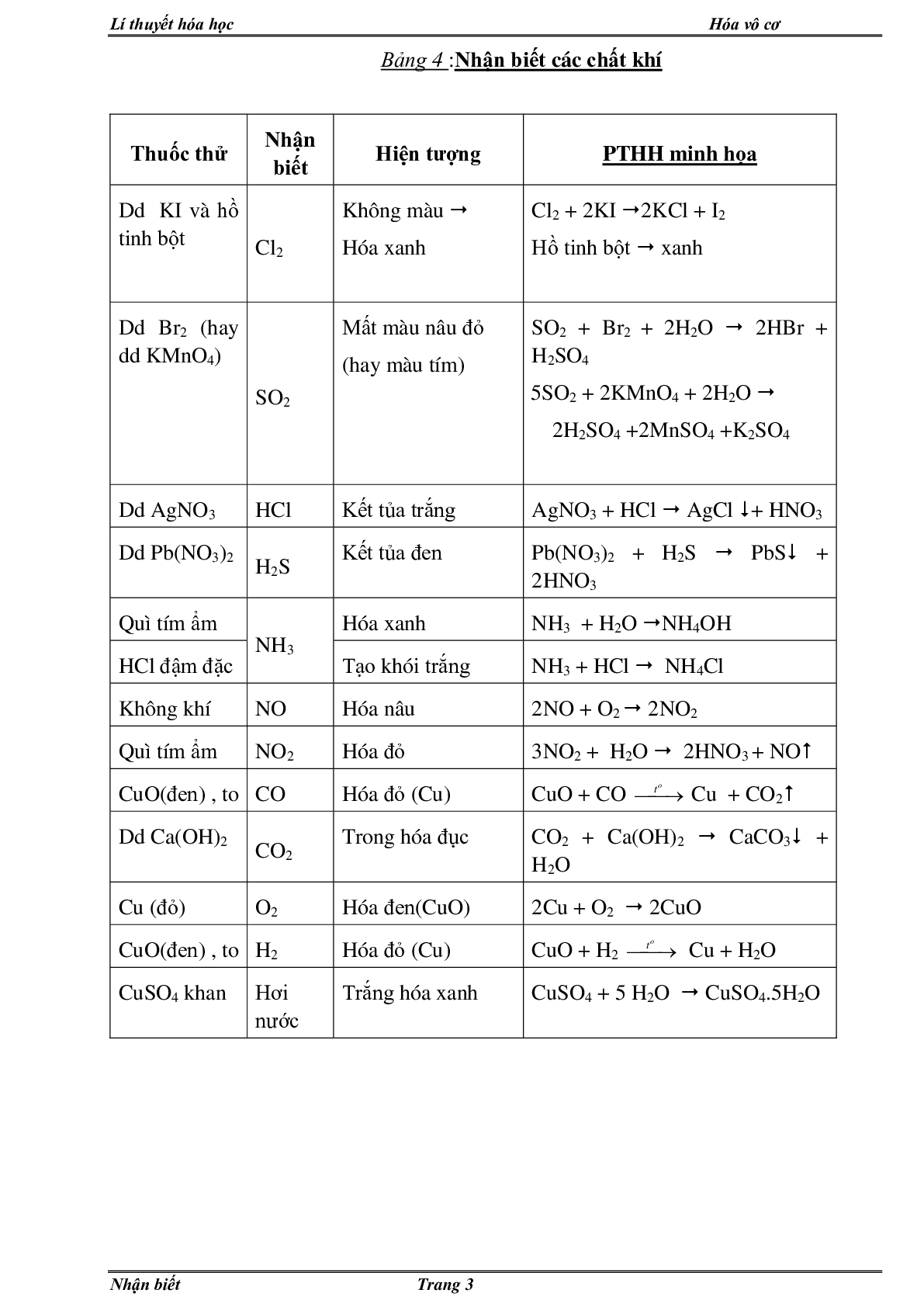
Bảng 4 :Nhận biết các chất khí
Thuốc thử Nhận biết Hiện tượng PTHH minh họa
Dd KI và hồ tinh bột Cl2 Không màu
Hóa xanh Cl2 + 2KI 2KCl + I2
Hồ tinh bột xanh
Dd Br2 (hay dd KMnO4) SO2 Mất màu nâu đỏ
(hay màu tím) SO2 + Br2 + 2H2O 2HBr + H2SO4
5SO2 + 2KMnO4 + 2H2O
2H2SO4 +2MnSO4 +K2SO4
Dd AgNO3 HCl Kết tủa trắng AgNO3 + HCl AgCl + HNO3
Dd Pb(NO3)2 H2S Kết tủa đen Pb(NO3)2 + H2S PbS + 2HNO3
Quì tím ẩm NH3 Hóa xanh NH3 + H2O NH4OH
HCl đậm đặc Tạo khói trắng NH3 + HCl NH4Cl
Không khí NO Hóa nâu 2NO + O2 2NO2
Quì tím ẩm NO2 Hóa đỏ 3NO2 + H2O 2HNO3 + NO
CuO(đen) , to CO Hóa đỏ (Cu) CuO + CO Cu + CO2
Dd Ca(OH)2 CO2 Trong hóa đục CO2 + Ca(OH)2 CaCO3 + H2O
Cu (đỏ) O2 Hóa đen(CuO) 2Cu + O2 2CuO
CuO(đen) , to H2 Hóa đỏ (Cu) CuO + H2 Cu + H2O
CuSO4 khan Hơi nước Trắng hóa xanh CuSO4 + 5 H2O CuSO4.5H2O
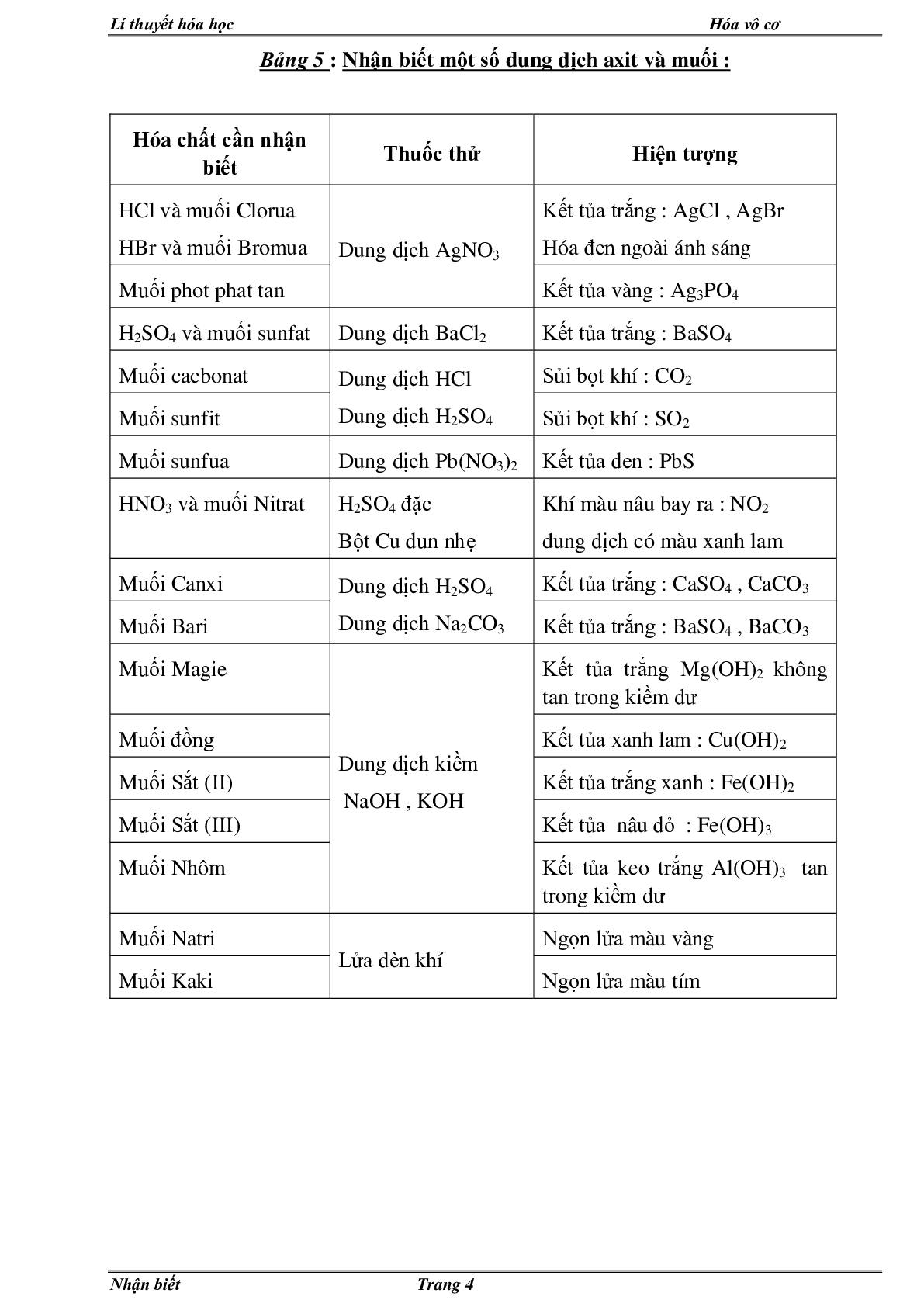
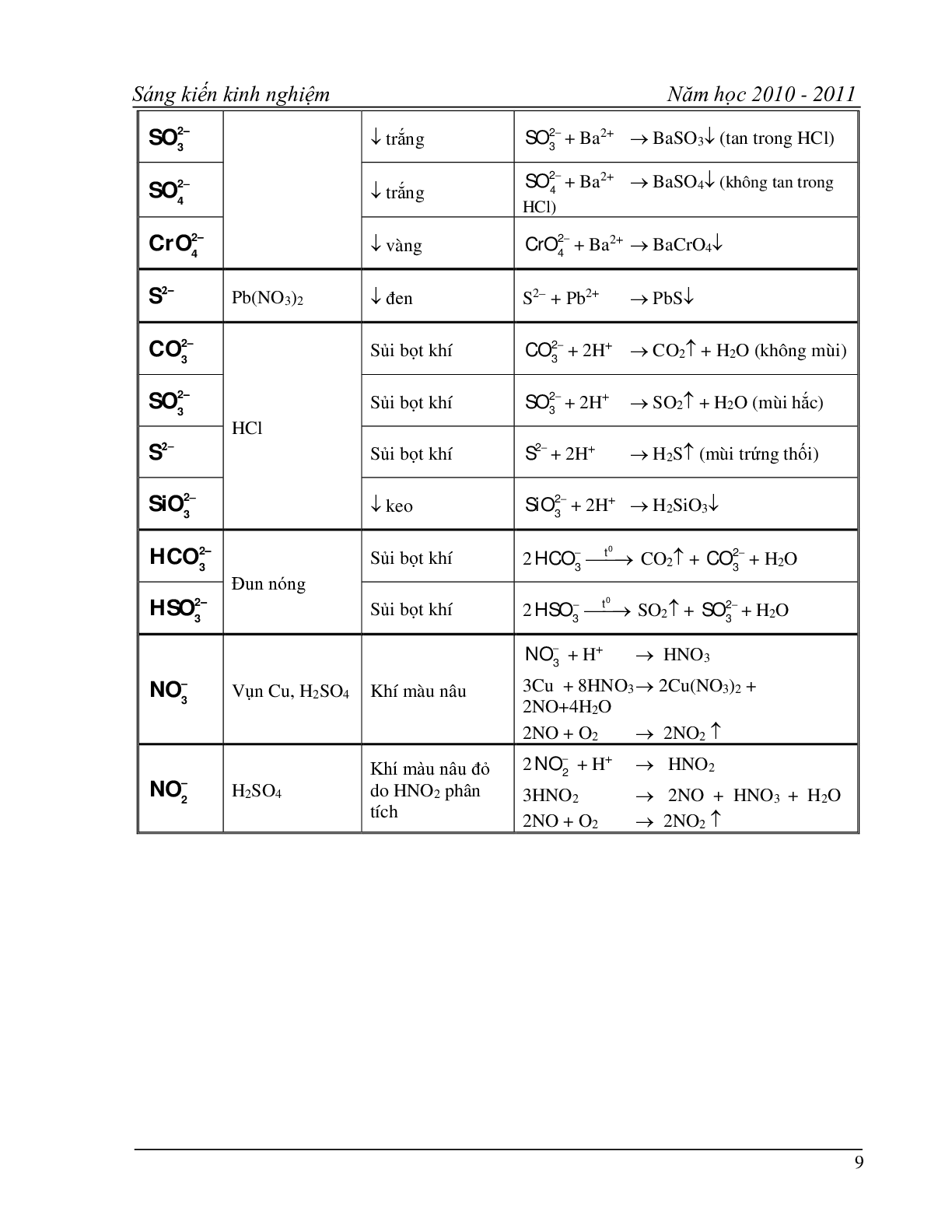
Bảng 5 : Nhận biết một số dung dịch axit và muối :
Hóa chất cần nhận biết Thuốc thử Hiện tượng
HCl và muối Clorua
HBr và muối Bromua Dung dịch AgNO3 Kết tủa trắng : AgCl , AgBr
Hóa đen ngoài ánh sáng
Muối phot phat tan Kết tủa vàng : Ag3PO4
H2SO4 và muối sunfat Dung dịch BaCl2 Kết tủa trắng : BaSO4
Muối cacbonat Dung dịch HCl
Dung dịch H2SO4 Sủi bọt khí : CO2
Muối sunfit Sủi bọt khí : SO2
Muối sunfua Dung dịch Pb(NO3)2 Kết tủa đen : PbS
HNO3 và muối Nitrat H2SO4 đặc
Bột Cu đun nhẹ Khí màu nâu bay ra : NO2
dung dịch có màu xanh lam
Muối Canxi Dung dịch H2SO4
Dung dịch Na2CO3 Kết tủa trắng : CaSO4 , CaCO3
Muối Bari Kết tủa trắng : BaSO4 , BaCO3
Muối Magie Dung dịch kiềm
NaOH , KOH Kết tủa trắng Mg(OH)2 không tan trong kiềm dư
Muối đồng Kết tủa xanh lam : Cu(OH)2
Muối Sắt (II) Kết tủa trắng xanh : Fe(OH)2
Muối Sắt (III) Kết tủa nâu đỏ : Fe(OH)3
Muối Nhôm Kết tủa keo trắng Al(OH)3 tan trong kiềm dư
Muối Natri Lửa đèn khí Ngọn lửa màu vàng
Muối Kaki Ngọn lửa màu tím
A.TRẠNG THÁI, MÀU SẮC CÁC ĐƠN CHẤT, HỢP CHẤT
Cr(OH)2 : vàng
Cr(OH) 3 : xanh
K2Cr2O7 : đỏ da cam
KMnO4 : tím
CrO3 : rắn, đỏ thẫm
Zn : trắng xanh
Zn(OH)2 : trắng
Hg : lỏng, trắng bạc
HgO : màu vàng hoặc đỏ
Mn : trắng bạc
MnO : xám lục nhạt
MnS : hồng nhạt
MnO2 : đen
H2S : khí không màu
SO2 : khí không màu
SO3 : lỏng, khong màu, sôi 450C
Br2 : lỏng, nâu đỏ
I2 : rắn, tím
Cl2 : khí, vàng
CdS : vàng
HgS : đỏ
AgF : tan
AgI : vàng đậm
AgCl : màu trắng
AgBr : vàng nhạt
HgI2 : đỏ
CuS, NiS, FeS, PbS, … : đen
C : rắn, đen
S : rắn, vàng
P : rắn, trắng, đỏ, đen
Fe : trắng xám
FeO : rắn, đen
Fe3O4 : rắn, đen
Fe2O3 : màu nâu đỏ
Fe(OH)2 : rắn, màu trắng xanh
Fe(OH)3 : rắn, nâu đỏ
Al(OH)3 : màu trắng, dạng keo tan trong NaOH
Zn(OH)2 : màu trắng, tan trong NaOH
Mg(OH)2 : màu trắng.
Cu: : rắn, đỏ
Cu2O: : rắn, đỏ
CuO : rắn, đen
Cu(OH)2 : xanh lam
CuCl2, Cu(NO3) 2, CuSO4.5H2O : xanh
CuSO4 : khan, màu trắng
FeCl3 : vàng
CrO : rắn, đen
Cr2O3 : rắn, xanh thẫm
BaSO4 : trắng, không tan trong axit.
BaCO3, CaCO3: trắng
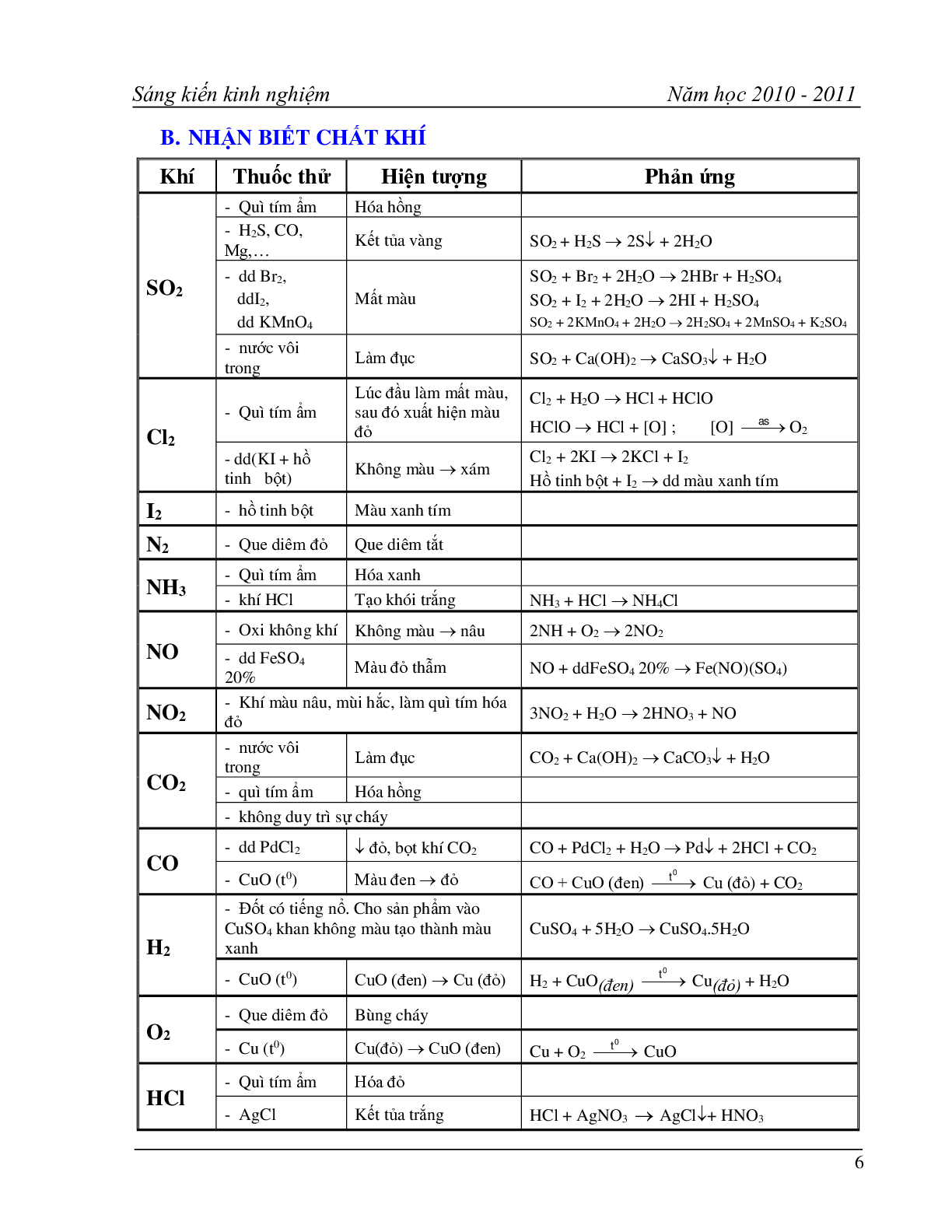
B. NHẬN BIẾT CHẤT KHÍ
Khí Thuốc thử Hiện tượng Phản ứng
SO2 - Quì tím ẩm Hóa hồng
- H2S, CO, Mg,…
- dd Br2,
ddI2,
dd KMnO4 Mất màu SO2 + Br2 + 2H2O 2HBr + H2SO4
SO2 + I2 + 2H2O 2HI + H2SO4
SO2 + 2KMnO4 + 2H2O 2H2SO4 + 2MnSO4 + K2SO4
- nước vôi trong Làm đục SO2 + Ca(OH)2 CaSO3 + H2O
Cl2 - Quì tím ẩm Lúc đầu làm mất màu, sau đó xuất hiện màu đỏ Cl2 + H2O HCl + HClO
HClO HCl + [O] ; [O] O2
- dd(KI + hồ tinh bột) Không màu xám Cl2 + 2KI 2KCl + I2
Hồ tinh bột + I2 dd màu xanh tím
I2 - hồ tinh bột Màu xanh tím
N2 - Que diêm đỏ Que diêm tắt
NH3 - Quì tím ẩm Hóa xanh
- khí HCl Tạo khói trắng NH3 + HCl NH4Cl
NO - Oxi không khí Không màu nâu 2NH + O2 2NO2
- dd FeSO4 20% Màu đỏ thẫm NO + ddFeSO4 20% Fe(NO)(SO4)
NO2 - Khí màu nâu, mùi hắc, làm quì tím hóa đỏ 3NO2 + H2O 2HNO3 + NO
CO2 - nước vôi trong Làm đục CO2 + Ca(OH)2 CaCO3 + H2O
- quì tím ẩm Hóa hồng
- không duy trì sự cháy
CO - dd PdCl2 đỏ, bọt khí CO2 CO + PdCl2 + H2O Pd + 2HCl + CO2
- CuO (t0) Màu đen đỏ CO + CuO (đen) Cu (đỏ) + CO2
H2 - Đốt có tiếng nổ. Cho sản phẩm vào CuSO4 khan không màu tạo thành màu xanh CuSO4 + 5H2O CuSO4.5H2O
- CuO (t0) CuO (đen) Cu (đỏ) H2 + CuO(đen) Cu(đỏ) + H2O
O2 - Que diêm đỏ Bùng cháy
- Cu (t0) Cu(đỏ) CuO (đen) Cu + O2 CuO
HC
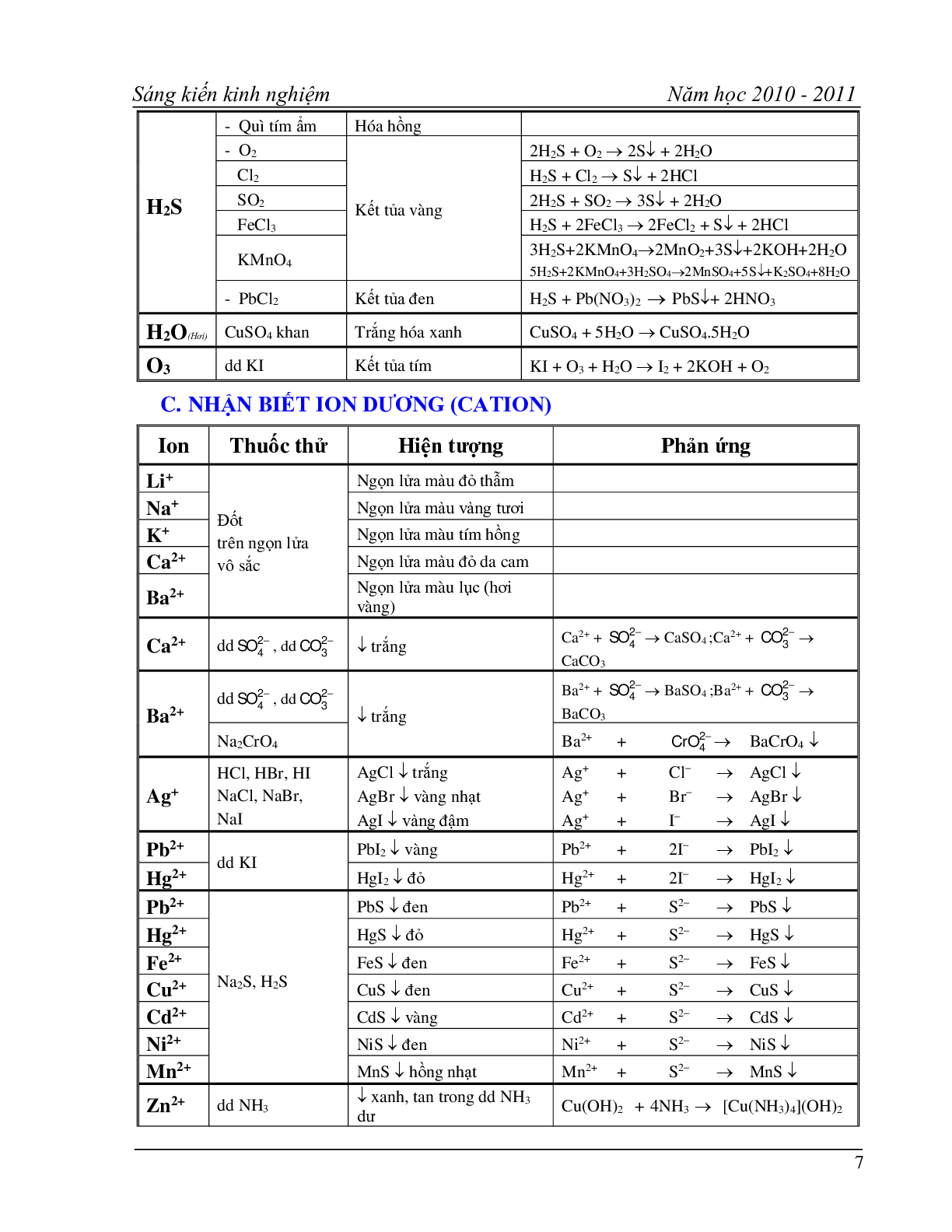
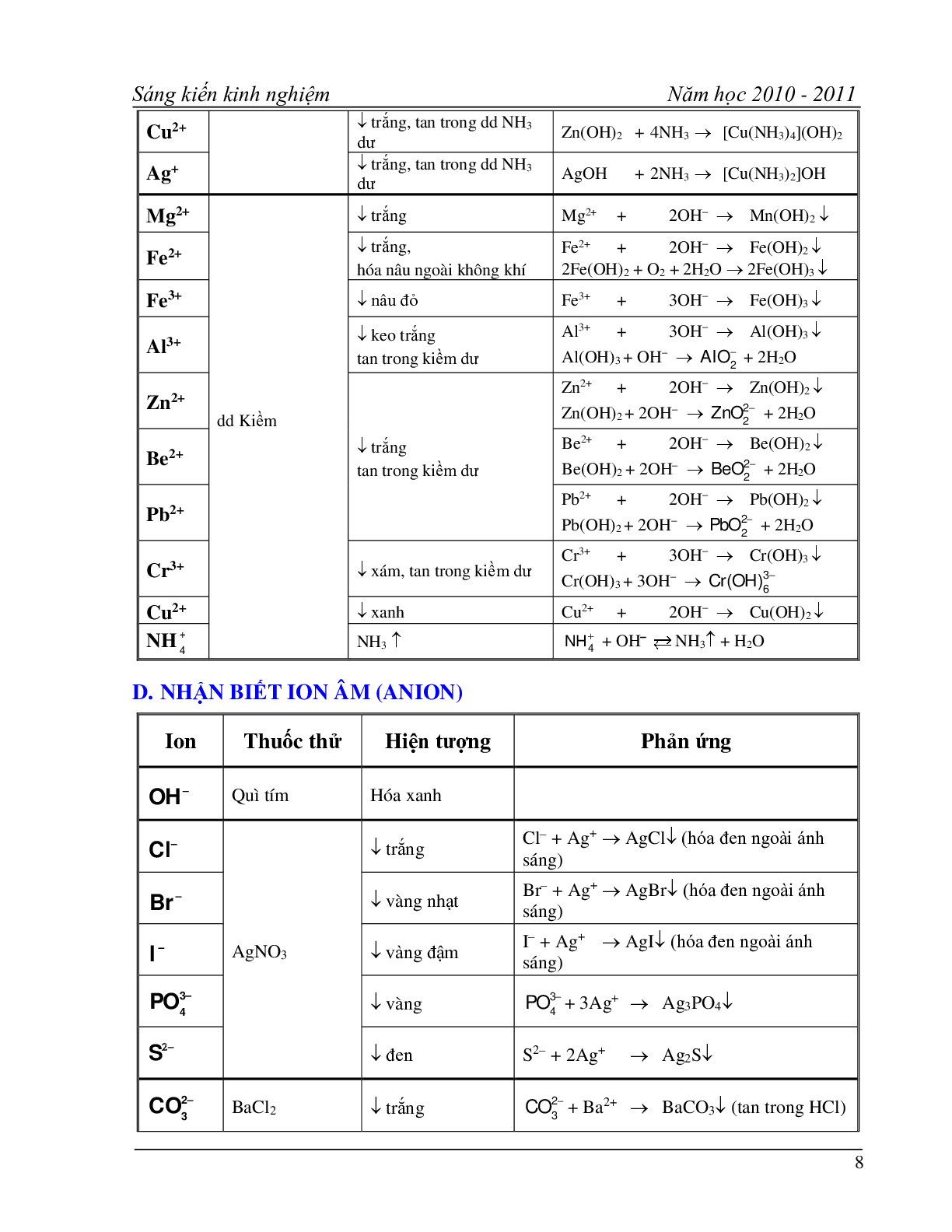
C. NHẬN BIẾT ION DƯƠNG (CATION)
Ion Thuốc thử Hiện tượng Phản ứng
Li+ Đốt
trên ngọn lửa
vô sắc Ngọn lửa màu đỏ thẫm
Na+ Ngọn lửa màu vàng tươi
K+ Ngọn lửa màu tím hồng
Ca2+ Ngọn lửa màu đỏ da cam
Ba2+ Ngọn lửa màu lục (hơi vàng)
Ca2+ dd , dd
C