Tailieumoi.vn xin giới thiệu phương trình H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Lưu huỳnh. Mời các bạn đón xem:
Phương trình H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
1. Phương trình phản ứng hóa học
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
2. Hiện tượng nhận biết xảy ra phản ứng
- Dung dịch nước clo bị mất màu.
3. Điều kiện xảy ra phản ứng
- H2S tác dụng với nước clo ở nhiệt độ thường.
4. Tính chất hoá học
4.1. Tính chất hoá học của H2S
Tính axit yếu
Hiđro sunfua tan trong nước tạo thành dung dịch axit rất yếu (yếu hơn axit cacbonic), có tên là axit sunfuhiđric (H2S).
Axit sunfuhiđric tác dụng với kiềm tạo nên 2 loại muối: muối trung hòa, như Na2S chứa ion S2- và muối axit như NaHS chứa ion HS−.
H2S + NaOH → NaHS + H2O
H2S + 2NaOH → Na2S + 2H2O
Tính khử mạnh
Là chất khử mạnh vì trong H2S lưu huỳnh có số oxi hoá thấp nhất (-2).
Khi tham gia phản ứng hóa học, tùy thuộc vào bản chất và nồng độ của chất oxi hóa, nhiệt độ,...mà nguyên tố lưu huỳnh có số oxi hóa −2 (S-2) có thể bị oxi hóa thành (S0), (S+4), (S+6).
- Tác dụng với oxi có thể tạo S hoặc SO2 tùy lượng ôxi và cách tiến hành phản ứng.
Ở nhiệt độ cao, khí H2S cháy trong không khí với ngọn lửa xanh nhạt, H2S bị oxi hóa thành SO2:
- Tác dụng với clo có thể tạo S hay H2SO4 tùy điều kiện phản ứng.
H2S + 4Cl2 + 4H2O → 8HCl + H2SO4
H2S + Cl2 → 2HCl + S (khí clo gặp khí H2S)
4.2. Tính chất hoá học của Cl2
Tác dụng với kim loại
Đa số kim loại và có to để khơi màu phản ứng tạo muối clorua (có hoá trị cao nhất )
Tác dụng với phi kim
(cần có nhiệt độ hoặc có ánh sáng)
Tác dụng với nước và dung dịch kiềm
Cl2 tham gia phản ứng với vai trò vừa là chất ôxi hóa, vừa là chất khử.
Tác dụng với nước
Khi hoà tan vào nước, một phần Clo tác dụng (Thuận nghịch)
Cl20 + H2O → HCl + HClO (Axit hipoclorơ)
Axit hipoclorơ có tính oxy hoá mạnh, nó phá hửy các màu vì thế nước clo hay clo ẩm có tính tẩy màu do.
Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Cl2 + 2KI → 2KCl + I2
Tác dụng với chất khử khác
Phản ứng thế, phản ứng cộng, phản ứng phân huỷ với một số hợp chất hữu cơ
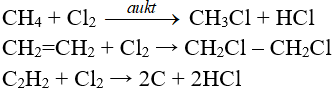
4.3. Tính chất hoá học của nước
– Tác dụng với kim loại: nước có thể tác dụng với một số kim loại ở nhiệt độ thường như Ca, Ba, K,…
K + H2O → KOH + H2
– Tác dụng với một số oxit bazo như CaO, K2O,… tạo ra bazo tương ứng Ca(OH)2, KOH,…
CaO + H2O → Ca(OH)2
– Tác dụng với oxit axit như SO3, P2O5,… tạo thành axit tương ứng H2SO4, H3PO4,…
SO3 + H2O → H2SO4
5. Cách tiến hành thí nghiệm
- Sục khí H2S vào dung dịch nước clo.
6. Bài tập liên quan
Câu 1: Trong phản ứng: Cl2 + H2O ↔ HCl + HClO clo đóng vai trò:
A. Là chất khử
B. Vừa là chất oxi hóa, vừa là chất khử
C. Là chất oxi hóa
D. Không là chất oxi hóa, không là chất khử
Hướng dẫn giải:
Đáp án B
Xét sự thay đổi số oxi hóa của Cl:
+ Tăng từ 0 lên +1 (trong HClO)
+ Giảm từ 0 xuống -1 (trong HCl)
⇒ Clo vừa là chất khử vừa là chất oxi hóa.
Câu 2: Xét phản ứng: 2Cl2 + 6KOH 5KCl + KClO3 + 3H2O.
Trong phản ứng trên, Cl2 đóng vai trò
A. chất khử.
B. vừa là chất oxi hóa, vừa là chất khử.
C. chất oxi hóa.
D. môi trường.
Hướng dẫn giải
Đáp án B
Câu 3: Trong phòng thí nghiệm, khí X được điều chế và thu vào bình tam giác bằng cách đẩy không khí như hình vẽ dưới đây:
Khí X là
A. Cl2.
B. N2.
C. H2.
D. NH3.
Hướng dẫn giải
Đáp án A
Phương pháp ngửa bình thu khí nặng hơn không khí =>Cl2 ( M = 71 > 29).
Câu 4: Cho m gam bột Fe tác dụng với khí Cl2 sau khi phản ứng kết thúc thu được m + 12,78 gam hỗn hợp X. Hoà tan hết hỗn hợp X trong nước cho đến khi X tan tối đa thì thuđược dung dịch Y và 1,12 gam chất rắn. Giá trị của m là.
A. 5,6 gam
B. 11,2 gam
C. 16,8 gam
D. 8,4 gam.
Hướng dẫn giải
Đáp án B
Bản chất phản ứng:
2Fe + 3Cl2 2FeCl3
Fe + 2FeCl3 → 3FeCl2
⇒ nFe pư = nClo
Câu 5: Cho 7,84 lít hỗn hợp khí X (đktc) gồm Cl2 và O2 phản ứng vừa đủ với 11,1 gam hỗn hợp Y gồm Mg và Al, thu được 30,1 gam hỗn hợp Z. Phần trăm khối lượng của Al trong Y là.
A. 75,68%.
B. 24,32%.
C. 51,35%.
D. 48,65%.
Hướng dẫn giải
Đáp án B
Đặt số mol Cl2 là x mol; số mol O2 là y mol. Theo bài ra ta có hệ phương trình:
Gọi số mol Mg và Al lần lượt là a và b mol. Theo bài ra ta có hệ phương trình:
Vậy %mAl =
Câu 6: Có phản ứng hoá học xảy ra như sau:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Câu nào diễn tả đúng tính chất các chất phản ứng?
A. H2S là chất khử, H2O là chất oxi hoá.
B. Cl2 là chất oxi hoá. H2O là chất khử.
C. H2S là chất oxi hoá, Cl2 là chất khử.
D. Cl2 là chất oxi hoá. H2S là chất khử.
Hướng dẫn giải
Đáp án D
PTHH: H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Trong phản ứng trên, số oxi hóa của lưu huỳnh tăng từ -2 lên +6 ⇒ H2S là chất khử
Số oxi hóa của Clo giảm từ 0 xuống -1 ⇒ Cl2 là chất oxi hóa
Câu 7: Cho sơ đồ của phản ứng:
H2S + KMnO4 + H2SO4 → H2O + S + MnSO4 + K2SO4
Hệ số cân bằng (là các số nguyên, tối giản) của các chất tham gia phản ứng là dãy số nào trong các dãy sau?
A. 3, 2, 5
B. 5, 2, 3
C. 2, 2, 5
D. 5, 2, 4
Hướng dẫn giải:
Đáp án B
5H2S + 2KMnO4+ 3H2SO4 → 8H2O + 5S + 2MnSO4+ K2SO4
Câu 8: Cho sơ đồ phản ứng hóa học: H2S + O2 (dư) X + H2O. Chất X có thể là
A. SO2
B. S
C. SO3
D. S hoặc SO2
Hướng dẫn giải:
Đáp án A
Do O2 dư nên X là SO2, phương trình hóa học:
H2S + 3O2 (dư) 2SO2 + 2H2O
Câu 9: Đốt cháy hoàn toàn 8,96 lít H2S (đktc) trong oxi dư, rồi dẫn tất cả sản phẩm vào 50 ml dung dịch NaOH 25% (D= 1,28). Nồng độ % muối trong dung dịch là
A. 47, 92%
B. 42, 96%
C. 42,69%
D. 24,97%
Hướng dẫn giải:
Đáp án B
; nNaOH = = 0,4 mol
2H2S + 3O2 → 2SO2+ 2H2O
Ta thấy: Tạo muối axit: NaOH + SO2 →NaHSO3
Theo PTHH:
→ mdd sau= 50.1,28 + 0,4.64 + 0,4.18 = 96,8g
→
Câu 10: Cho sản phẩm khí thu được khi đốt cháy 17,92 lít khí H2S (đktc) sục vào 200 ml dung dịch NaOH 25% (d = 1,28g/ml). Tính nồng độ phần trăm muối trong dung dịch ?
A. 32,81%
B. 23,81%
C. 18,23%
D. 18,32%
Hướng dẫn giải:
Đáp án A
BTNT “S”:
m dd NaOH = 200.1,28 = 256 gam
→ mNaOH = 256.25% = 64 gam
→ nNaOH = 1,6 mol
→ Muối sinh ra là Na2SO3
2NaOH + SO2 → Na2SO3 + H2O
Theo PTHH:
Khối lượng dung dịch sau phản ứng :
m dd sau pư = 256 + 0,8.64 = 307,2 gam
Vậy
Câu 11: Cho khí H2S lội qua dung dịch CuSO4 thấy có kết tủa màu xám đen xuất hiện, chứng tỏ:
A. Có phản ứng oxi hóa - khử xảy ra
B. Có kết tủa CuS tạo thành, không tan trong axit mạnh
C. Axit sunfuhiđric mạnh hơn axit sunfuric
D. axit sunfuric mạnh hơn axit sunfuhiđric
Hướng dẫn giải:
Đáp án B
H2S + CuSO4 → CuS↓ + H2SO4
Câu 12: Dung dịch H2S để lâu ngày trong không khí thường có hiện tượng gì:
A. Chuyển thành màu nâu đỏ
B. Bị vẩn đục, màu vàng
C. Vẫn trong suốt không màu
D. Xuất hiện chất rắn màu đen.
Hướng dẫn giải:
Đáp án B
2H2S + O2 → 2S(↓ vàng) + 2H2O
Câu 13: Sục 2,24 lít khí H2S (đktc) vào dung dịch 0,2 mol Ba(OH)2 thì khối lượng muối tan thu được là:
A. 40,6 g
B. 33,8 g
C. 16,9 g
D. Kết quả khác
Hướng dẫn giải:
Đáp án C
→ Tỉ lệ : < 1 → tạo muối BaS
H2S + Ba(OH)2 → BaS + 2H2O
0,10,2→0,1
→ m BaS = 0,1 . 169 = 16,9 g
7. Một số phương trình phản ứng hoá học khác của Lưu huỳnh (S) và hợp chất:
3H2S + 2HNO3 → 4H2O + 2NO↑ + 3S↓
H2S + 2FeCl3 → S↓ + 2FeCl2 + 2HCl
3H2S + 2KMnO4 → 2KOH + 2MnO2↓ + 3S↓ + 2H2O
H2S + 4Br2 + 4H2O → 8HBr + H2SO4