Tailieumoi.vn xin giới thiệu phương trình 2H2S + 3O2 2SO2↑ + 2H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Lưu huỳnh. Mời các bạn đón xem:
Phương trình 2H2S + 3O2 2SO2↑ + 2H2O
1. Phương trình phản ứng hóa học
2H2S + 3O2 2SO2↑ + 2H2O
2. Hiện tượng nhận biết phản ứng
Có khí mùi hắc thoát ra SO2.
3. Điều kiện phản ứng
Nhiệt độ, O2 dư.
4. Tính chất hoá học
4.1. Tính chất hoá học của H2S
Tính axit yếu
Hiđro sunfua tan trong nước tạo thành dung dịch axit rất yếu (yếu hơn axit cacbonic), có tên là axit sunfuhiđric (H2S).
Axit sunfuhiđric tác dụng với kiềm tạo nên 2 loại muối: muối trung hòa, như Na2S chứa ion S2- và muối axit như NaHS chứa ion HS−.
H2S + NaOH → NaHS + H2O
H2S + 2NaOH → Na2S + 2H2O
Tính khử mạnh
Là chất khử mạnh vì trong H2S lưu huỳnh có số oxi hoá thấp nhất (-2).
Khi tham gia phản ứng hóa học, tùy thuộc vào bản chất và nồng độ của chất oxi hóa, nhiệt độ,...mà nguyên tố lưu huỳnh có số oxi hóa −2 (S-2) có thể bị oxi hóa thành (S0), (S+4), (S+6).
- Tác dụng với oxi có thể tạo S hoặc SO2 tùy lượng ôxi và cách tiến hành phản ứng.
Ở nhiệt độ cao, khí H2S cháy trong không khí với ngọn lửa xanh nhạt, H2S bị oxi hóa thành SO2:
- Tác dụng với clo có thể tạo S hay H2SO4 tùy điều kiện phản ứng.
H2S + 4Cl2 + 4H2O → 8HCl + H2SO4
H2S + Cl2 → 2HCl + S (khí clo gặp khí H2S)
4.2. Tính chất hoá học của O2
Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ au và Pt), cần có to tạo oxit:
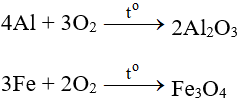
Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
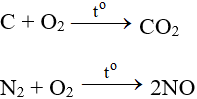
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
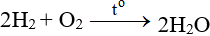
Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
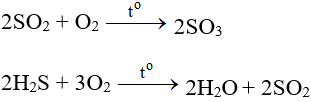
- Tác dụng với các chất hữu cơ:
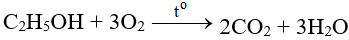
5. Cách thực hiện phản ứng
Đốt cháy khí H2S ở trong khí oxi dư ở nhiệt độ cao.
6. Bạn có biết
Nếu đốt cháy khí H2S ở nhiệt độ không cao hoặc thiếu oxi, khí H2S bị oxi hóa thành S.
2H2S + O2 2S + 2H2O
7. Bài tập liên quan
Ví dụ 1: Khí SO2 là khí rất độc, để hấp thụ khí SO2 thoát ra người ta dùng dung dịch nào sau đây?
A. NaCl
B. NaOH
C. HCl
D. KCl
Hướng dẫn giải
Đáp án đúng là: B
Dùng dung dịch kiềm để hấp thụ khí SO2.
SO2 + 2NaOH → Na2SO3 + H2O
Ví dụ 2: Đốt cháy khí H2S ở trong khí oxi dư ở nhiệt độ cao, thu được khí X. Khí X là
A. SO3
B. H2S
C. SO2
D. H2
Hướng dẫn giải
Đáp án đúng là: C
Phương trình hóa học:
2H2S + 3O2 → 2SO2↑ + 2H2O
⇒ Khí X là SO2.
Ví dụ 3: Đốt cháy 2,24 lít khí H2S ở trong khí oxi dư ở nhiệt độ cao, thu được V lít khí X ở đktc. Giá trị của V là
A. 2,24
B. 3,36
C. 4,48
D. 8,96
Hướng dẫn giải
Đáp án đúng là: A
Ta có: = 0,1 mol
Phương trình hóa học:
⇒ V = 0,1. 22,4 = 2,24 lít
8. Một số phương trình phản ứng hoá học khác của Lưu huỳnh (S) và hợp chất:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
3H2S + 2HNO3 → 4H2O + 2NO↑ + 3S↓
H2S + 2FeCl3 → S↓ + 2FeCl2 + 2HCl
3H2S + 2KMnO4 → 2KOH + 2MnO2↓ + 3S↓ + 2H2O
H2S + 4Br2 + 4H2O → 8HBr + H2SO4