Tailieumoi.vn xin giới thiệu phương trình S + 2H2SO4 đặc 3SO2↑ + 2H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Lưu huỳnh. Mời các bạn đón xem:
Phương trình S + 2H2SO4 đặc 3SO2↑ + 2H2O
1. Phương trình phản ứng hóa học
S + 2H2SO4 đặc 3SO2↑ + 2H2O
2. Hiện tượng nhận biết phản ứng
Chất rắn màu vàng tan dần và xuất hiện khí mùi hắc làm sủi bọt khí
3. Điều kiện phản ứng
Nhiệt độ, H2SO4 đặc
4. Tính chất hoá học
4.1. Tính chất hoá học của Lưu huỳnh
Nhận xét: khi tham gia phản ứng hóa học, S thể hiện tính oxi hóa hoặc tính khử
Tác dụng với kim loại
S có thể tác dụng với nhiều kim loại ở nhiệt độ cao
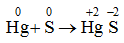
Tác dụng với hiđro
Trong các phản ứng trên, số oxi hóa của S giảm từ 0 xuống -2 → S thể hiện tính oxi hóa
Tác dụng với phi kim
Ở điều kiện thích hợp, S tác dụng được với một số phi kim như oxi, clo, flo,…
Tác dụng với hợp chất
Trong các phản ứng trên, số oxi hóa của S tăng từ 0 lên +4 hoặc +6 → S thể hiện tính khử
4.2. Tính chất hoá học của H2SO4
Axit sunfuric loãng
- Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb)
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo
FeO + H2SO4 → FeSO4 + H2O
- Tác dụng với bazo
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- Tác dụng với muối
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
Axit sunfuric đặc
- Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại:
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
5. Cách thực hiện phản ứng
Đun nóng S với H2SO4 đặc.
6. Bạn có biết
Khí SO2 là một khí độc do đó quá trình làm thí nghiệm cần dùng bông tẩm kiềm tránh khí SO2 thoát ra ngoài.
7. Bài tập liên quan
Ví dụ 1: Đun nóng S với H2SO4 đặc, dư hiện tượng phản ứng xảy ra là:
A. không có hiện tượng gì.
B. có khí mùi hắc thoát ra.
C. xuất hiện kết tủa vàng.
D. chất rắn màu vàng tan dần, có khí mùi hắc thoát ra.
Hướng dẫn giải
Đáp án đúng là: D
S + 2H2SO4 → 3SO2↑ + 2H2O
Hiện tượng: Chất rắn màu vàng (S) tan dần, có khí mùi hắc thoát ra.
Ví dụ 2: Cho S tác dụng với H2SO4 đặc, nóng dư. Trong phản ứng này, tỉ lệ số nguyên tử S bị khử với số nguyên tử S bị oxi hóa là:
A. 2: 1
B. 1: 2
C. 1: 3
D. 3: 1
Hướng dẫn giải
Đáp án đúng là: A
Phương trình hóa học:
S + 2H2SO4 → 3SO2↑ + 2H2O
⇒ Tỉ lệ số nguyên tử S bị khử với số nguyên tử S bị oxi hóa là 1:2.
Ví dụ 3: Đun nóng 1,6 gam S với H2SO4 đặc, dư thu được V (lít) khí ở đktc. Giá trị V là
A. 1,12
B. 2,24
C. 3,36
D. 4,48
Hướng dẫn giải
Đáp án đúng là: C
Ta có: nS = = 0,05 mol
Phương trình hóa học:
S + 2H2SO4 → 3SO2↑+ 2H2O
⇒ = 3. nS = 3.0,05 = 0,15 mol
⇒ V = 0,15.22,4 = 3,36 lít
8. Một số phương trình phản ứng hoá học khác của Lưu huỳnh (S) và hợp chất:
H2S + H2SO4 đậm đặc → SO2↑+ 2H2O + S↓
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl