Lời giải bài tập Hóa học lớp 11 Bài 15: Alkane sách Kết nối tri thức hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 11 Bài 15 từ đó học tốt môn Hóa 11.
Giải bài tập Hóa học lớp 11 Bài 15: Alkane
Lời giải:
- Thành phần chính của khí thiên nhiên, khí dầu mỏ, xăng, nhiên liệu phản lực (jet fuel) và dầu diesel là các alkane.
- Ngoài ra, các alkane còn là nguồn nguyên liệu quan trọng cho công nghiệp sản xuất các hoá chất hữu cơ hiện nay.
I. Khái niệm, danh pháp
Lời giải:
- Đồng phân không phân nhánh:
CH3 – CH2 – CH2 – CH2 – CH3: pentane.
- Đồng phân phân nhánh:
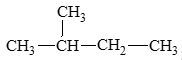
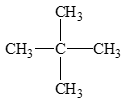
Câu hỏi 2 trang 84 Hóa học 11: Viết công thức cấu tạo của alkane có tên gọi 2 – methylpropane.
Lời giải:
2 – methylpropane:
Lời giải:
Tên gọi của chất này bị sai vị trí nhánh.
Sửa lại: 2 – methylbutane.
III. Tính chất vật lí
Lời giải:
Nhiệt độ sôi của các alkane tăng dần theo chiều tăng của phân tử khối.
IV. Tính chất hoá học
Hoạt động trang 86 Hóa học 11: Phản ứng bromine hoá hexane
Chuẩn bị: ống nghiệm, hexane, nước bromine, cốc thuỷ tinh.
Tiến hành:
- Cho vào ống nghiệm khoảng 1 mL hexane rồi cho tiếp vào đó khoảng 1 mL nước bromine. Quan sát thấy ống nghiệm có hai lớp, lớp dưới là nước bromine màu vàng, lớp trên là hexane không màu.
- Lắc đều và quan sát hiện tượng.
- Đặt ống nghiệm vào cốc nước ấm (khoảng 50 °C), quan sát hiện tượng xảy ra.
Trả lời câu hỏi:
1. Nêu hiện tượng xảy ra trong quá trình thí nghiệm. Giải thích.
2. Viết phương trình hoá học ở dạng công thức phân tử của phản ứng xảy ra trong thí nghiệm trên (nếu có), giả thiết là chỉ có một nguyên tử hydrogen được thay thế.
Lời giải:
1. Ban đầu ống nghiệm có hai lớp, lớp dưới là bromine màu vàng, lớp trên là hexane không màu.
Sau khi đặt ống nghiệm vào cốc nước nóng, thu được hỗn hợp không có màu.
2. Phương trình hoá học:
Br2 + C6H14 C6H13Br + HBr.
Lời giải:
2. Phản ứng cracking
3. Phản ứng reforming
4. Phản ứng oxi hoá
Hoạt động trang 88 Hóa học 11: Phản ứng oxi hoá hexane
Chuẩn bị: hexane, dung dịch KMnO4 1%; ống nghiệm, bát sứ, que đóm.
Tiến hành:
1. Phản ứng của hexane với dung dịch KMnO4
Cho khoảng 1 mL hexane vào ống nghiệm, thêm vài giọt dung dịch KMnO4 1%, lắc đều ống nghiệm trong khoảng 5 phút, sau đó đặt ống nghiệm vào giá rồi để yên khoảng 10 phút. Quan sát thấy ống nghiệm có 2 lớp, lớp dưới là dung dịch KMnO4 trong nước màu tím, lớp trên là hexane không màu.
2. Phản ứng đốt cháy hexane
Cho khoảng 1 mL hexane (lưu ý không được lấy nhiều hơn) vào bát sứ nhỏ, cẩn thận đưa que đóm đang cháy vào bề mặt chất lỏng, hexane bốc cháy cho ngọn lửa màu vàng.
Trả lời câu hỏi:
a) Hexane có phản ứng với dung dịch KMnO4 ở điều kiện thường không? Tại sao?
b) Tại sao lại đốt cháy hexane trong bát sứ mà không nên đốt trong cốc thuỷ tinh? Viết phương trình hoá học của phản ứng xảy ra.
c) Nếu đốt cháy hexane trong điều kiện thiếu oxygen sẽ tạo ra carbon monoxide và nước. Hãy viết phương trình hoá học của phản ứng này.
Lời giải:
a) Hexane không phản ứng với dung dịch KMnO4 ở điều kiện thường. Do ở phân tử hexane chỉ có các liên kết đơn C – C và C – H, đó là các liên kết σ bền vững, vì thế hexane tương đối trơ về mặt hoá học, không phản ứng với chất oxi hoá mạnh như KMnO4.
b) Đốt cháy hexane trong bát sứ mà không nên đốt trong cốc thuỷ tinh do phản ứng này toả ra lượng nhiệt lớn có thể làm vỡ cốc thuỷ tinh.
Phương trình hoá học minh hoạ:
c) Đốt cháy hexane trong điều kiện thiếu oxygen:
Câu hỏi 6 trang 88 Hóa học 11: Viết phương trình hoá học của phản ứng đốt cháy hoàn toàn pentane.
Lời giải:
V. Ứng dụng
Lời giải:
Do xăng, dầu dễ bay hơi, dễ bắt lửa, dễ cháy do đó ở các cây xăng, kho chứa xăng dầu thường treo các biển cấm lửa, cấm hút thuốc.
Lý thuyết Alkane
1. Khái niệm, danh pháp
a. Khái niệm và công thức chung của alkane
Alkane là các hydrocarbon no mạch hở chỉ chứa liên kết đơn C-H và C-C trong phân tử.
Công thức chung của alkane là: CnH2n+2 (n là số nguyên, n ≥ 1)
b. Danh pháp
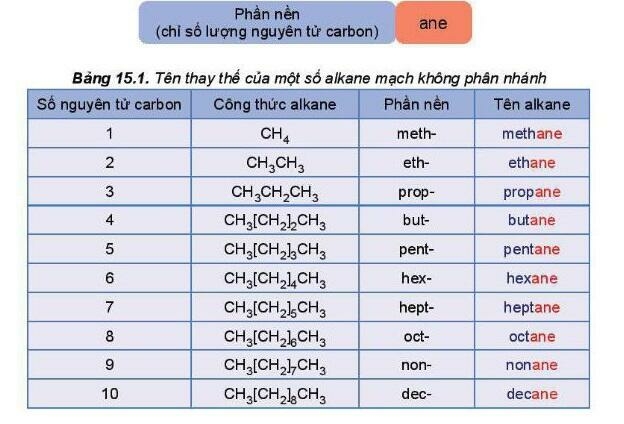
* Alkane không phân nhánh
Tên theo danh pháp thay thế của alkane mạch không phân nhánh:
* Alkane mạch nhánh
- Gốc alkyl: Phần còn lại sau khi lấy đi một nguyên tử hydrogen từ phân tử alkane (công thức chung của gốc alkyl là CnH2n+1
Tên gốc alkyl:

- Alkane mạch nhánh gồm alkane mạch chính kết hợp với một hay nhiều nhánh.
Tên theo danh pháp thay thế của alkane mạch phân nhánh:

2. Đặc điểm cấu tạo
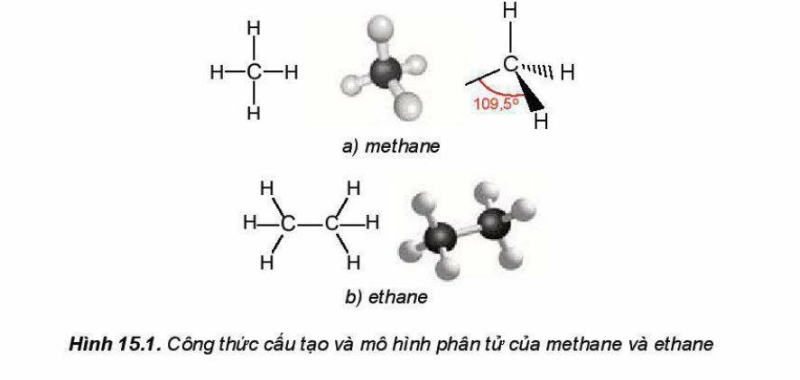
Trong phân tử alkane chỉ chứa các liên kết đơn C-C và C-H, các liên kết này là liên kết ở Ϭ bền vững và kém phân cực.
Trong phân tử methane, bốn liên kết C-H giống nhau tạo với nhau một gốc 109,5o và hướng về bốn đỉnh của một từ diện đều.
3. Tính chất vật lý
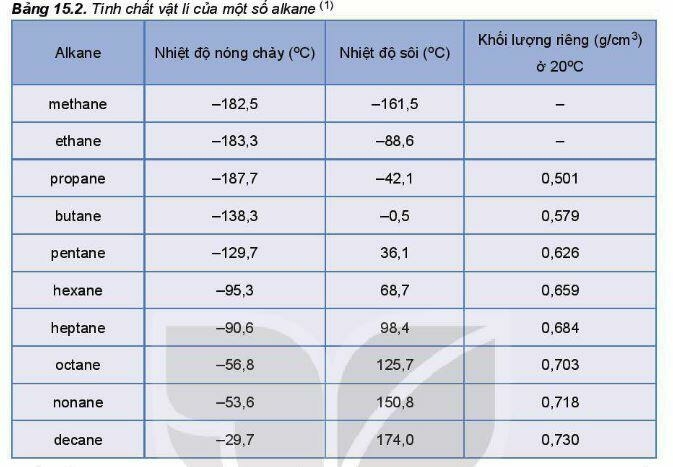
Ở điều kiện thường, alkane từ C1 đến C4 và neopentane ở trang thái khí, từ C5 đến C17 (trừ neopentane) ở trạng thái lỏng, không màu, alkane từ C18 trở lên là chất rắn màu trắng (còn gọi là sáp parafin). Các alkane mạch nhánh thường có nhiệt độ sôi thấp hơn so với đồng phân alkane mach không phân nhánh. Alkane không tan hoặc tan rất ít trong nước và nhẹ hơn nước, tan tốt hơn trong các dung môi hữu cơ.
4. Tính chất hoá học
a. Phản ứng thế
Phản ứng halogen hóa alkane là phản ứng xảy ra khi đặt bình chứa hỗn hợp của alkane với halogen ở nơi có ánh sáng hoặc ở nhiệt độ cao (đun nóng). Sản phẩm của phản ứng halogen hóa là các dẫn xuất halogen.
Phản ứng thế có thể tiếp tục diễn ra với các nguyên tử hydrogen chloromethane cho hỗn hợp các sản phẩm chloromethane, dichloromethane, trichloromethane và tetrachloromethane.
b. Phản ứng cracking
Cracking alkane là quá trình phân cắt liên kết C-C (bẻ gẫy mạch carbon) của các alkane mạch dài để tạo thành hỗn hợp các hydrocarbon có mạch carbon ngắn hơn.
c. Phản ứng reforming
Reforming alkane là quá trình chuyển các alkane mạch không phân nhánh thành các alkane mạch phân nhánh và các hydrocarbon mạch vòng nhưng không làm thay đổi.
d. Phản ứng oxi hoá
* Phản ứng oxi hoá hoàn toàn (phản ứng cháy)
Khi tiếp xúc với oxygen và có tin lớn khơi mào, alkane bị đốt cháy trở thành khí carbon dioxide, hai nước và giải phóng năng lượng.
* Phản ứng oxi hoá không hoàn toàn
Ở nhiệt độ cao, có mặt xúc tác, alkane bị oxi hoá cắt mạch carbon bởi oxygen tạo thành hỗn hợp carboxylic acid.
5. Ứng dụng
- Sử dụng làm nhiên liệu trong sản xuất và đời sống.
- Sản xuất phân bón urea, hydrogen và ammonia. Các alkane lỏng được sử dụng làm nhiên liệu xăng, diesel và nhiên liệu phản lực....
6. Điều chế
a. Phương pháp điều chế alkane
Sau khi loại bỏ các hợp chất không phải là hydrocarbon (đặc biệt là H2S và CO2), khi được dẫn qua đường ống dẫn đến nơi tiêu thụ hoặc được nên lại ở dạng lỏng để dễ dàng vận chuyển.
b. Phương pháp điều chế alkane ở thể lỏng, rắn trong công nghiệp
Khi chưng cất dầu mỏ nhận được hỗn hợp alkane có chiều dài mạch carbon khác nhau ở các phân đoạn sôi khác nhau. Để nhận được các alkane tinh khiết cần phải có các công nghệ tách và tinh chế rất phức tạp.
7. Ô nhiễm không khí do phương tiện giao thông
a. Các chất trong khí thái của phương tiện giao thông gây ô nhiễm không khí
- Quá trình cháy của xăng, dầu diesel trong động cơ các phương tiện giao thông là nguyên nhân chính gây hiệu ứng nhà kính làm Trái Đất nóng lên.
- Ngoài ra quá trình cháy tạo nhiệt độ cao khiến oxygen và nitrogen trong không khi phản ứng với nhau, tạo thành các loại oxide của nitrogen (NO2). Các chất này gây ô nhiễm môi trường không khí.
b. Một số biện pháp hạn chế ô nhiễm môi trường do các phương tiện giao thông
- Sử dụng nhiên liệu cháy sạch.
- Sử dụng nhiên liệu sinh học như xăng pha thêm ethanol (E5, E10...), blodiesel.
- Sử dụng các phương tiện giao thông tiết kiệm năng lượng và chuyển đổi sang các loại động cơ điện
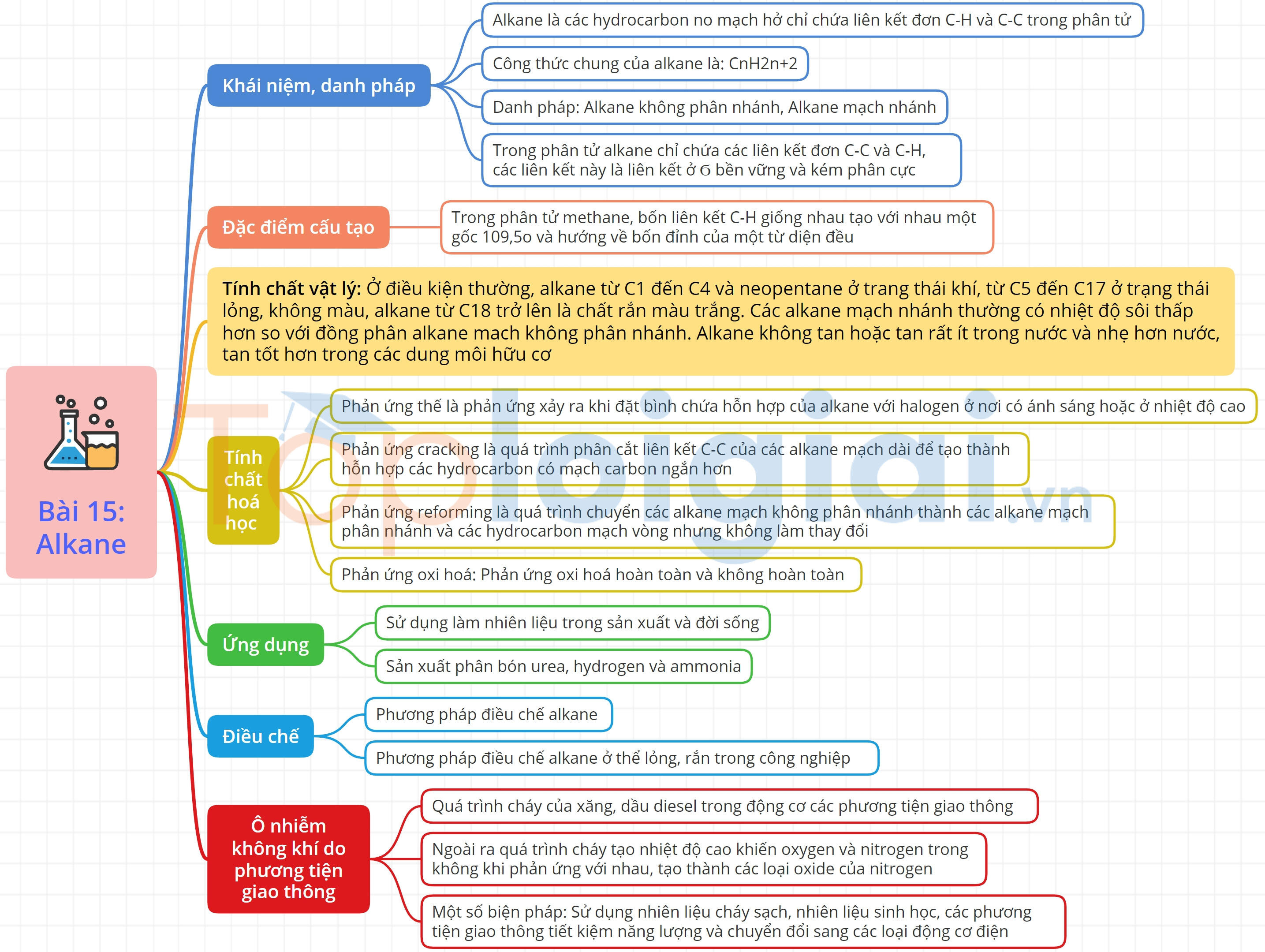
Sơ đồ tư duy Alkane
Xem thêm các bài giải SGK Hóa lớp 11 Kết nối tri thức hay, chi tiết khác: