Lời giải bài tập Khoa học tự nhiên lớp 7 Bài 1: Nguyên tử sách Cánh diều hay, ngắn gọn sẽ giúp học sinh dễ dàng trả lời câu hỏi KHTN 7 Bài 1 từ đó học tốt môn Khoa học tự nhiên 7.
Giải bài tập KHTN lớp 7 Bài 1: Nguyên tử
Video giải KHTN 7 Bài 1: Nguyên tử - Cánh diều
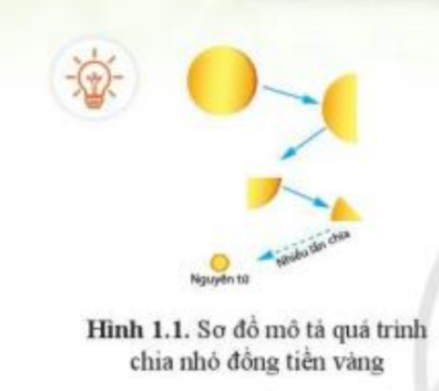
Trả lời:
Nguyên tử không phải là hạt nhỏ nhất. Trong nguyên tử còn có các hạt: electron, proton, neutron
1. Nguyên tử là gì
Câu hỏi 1 trang 10 KHTN lớp 7: Hãy cho biết nguyên tử là gì
Phương pháp giải:
Nguyên tử là những hạt cực kì nhỏ, không mang điện
Trả lời:
Nguyên tử là những hạt cực kì nhỏ bé, không mang điện
Ví dụ: Đồng tiền vàng được cấu tạo từ nguyên tử vàng
Kim cương, than chì đều được cấu tạo từ nguyên tử carbon
Nước được tạo nên từ các nguyên tử hydrogen và oxygen
Câu hỏi 2 trang 10 KHTN lớp 7: Kể tên hai chất có chứa nguyên tử oxygen
Phương pháp giải:
Khí oxygen, đường ăn
Trả lời:
Hai chất có chứa nguyên tử oxygen là:
+ Khí oxygen được cấu tạo từ nguyên tử oxygen
+ Đường ăn được tạo nên từ các nguyên tử carbon, hydrogen và oxygen
2. Cấu tạo nguyên tử
Câu hỏi 3 trang 11 KHTN lớp 7: Trong các hạt cấu tạo nên nguyên tử:
a) Hạt nào mang điện tích âm?
b) Hạt nào mang điện tích dương?
c) Hạt nào không mang điện
Phương pháp giải:
Nguyên tử gồm hạt nhân nguyên tử và vỏ nguyên tử
- Vỏ nguyên tử: 1 hay nhiều electron mang điện tích âm
- Hạt nhân nguyên tử:
+ Proton mang điện tích dương
+ Neutron không mang điện
Trả lời:
Trong các hạt cấu tạo nên nguyên tử:
a) Hạt electron (e) mang điện tích âm
b) Hạt proton (p) mang điện tích dương
c) Hạt neutron (n) không mang điện
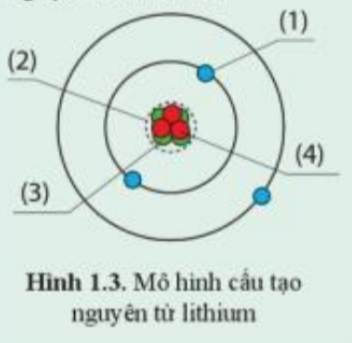
Phương pháp giải:
Quan sát hình 1.2 để hoàn thành hình 1.3
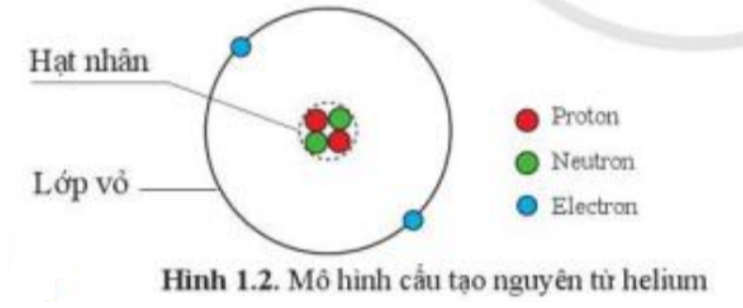
Trả lời:
(1): Electron
(2): Hạt nhân
(3): Neutron
(4): Proton
Luyện tập 2 trang 11 KHTN lớp 7: Hoàn thành thông tin trong bảng sau:
| Nguyên tử | Số proton | Số neutron | Số electron | Điện tích hạt nhân |
| Hydrogen | 1 | 0 | ? | ? |
| Carbon | ? | 6 | 6 | ? |
| Nhôm | 13 | 14 | ? | ? |
Phương pháp giải:
- Điện tích hạt nhân = tổng điện tích của các proton (mang điện tích dương)
- Trong nguyên tử, số electron = số proton
Trả lời:
- Hydrogen có số proton = 1 => Số electron = 1 và điện tích hạt nhân = +1
- Carbon có số electron = 6 => Số proton = 6 => Điện tích hạt nhân = +6
- Nhôm có số proton = 13 => Số electron = 13 và điện tích hạt nhân = +13
Hoàn thành bảng
| Nguyên tử | Số proton | Số neutron | Số electron | Điện tích hạt nhân |
| Hydrogen | 1 | 0 | 1 | +1 |
| Carbon | 6 | 6 | 6 | +6 |
| Nhôm | 13 | 14 | 13 | +13 |
Phương pháp giải:
- Hạt nhân gồm có prton và neutron
- Số đơn vị điện tích hạt nhân = số proton
- Trong nguyên tử, số electron = số proton
Trả lời:
- Vì hạt nhân gồm có proton và neutron
=> Tổng số hạt trong hạt nhân = số proton + số neutron
=> 27 = số proton + số neutron
- Mà số đơn vị điện tích hạt nhân = số proton = 13 = số electron
=> Số neutron = 27 – 13 = 14
Vậy trong nguyên tử nhôm có: 13 hạt electron, 13 hạt proton, 14 hạt neutron
Tìm hiểu thêm trang 12 KHTN lớp 7: Điện tích của nguyên tử helium bằng bao nhiêu?

Tổng điện tích trong nguyên tử helium bằng 0. Ta nói nguyên tử không mang điện hay trung hòa về điện
Cho biết nguyên tử lưu huỳnh (sulfur) có 16 electron. Hỏi nguyên tử lưu huỳnh có bao nhiêu proton? Hãy chứng minh nguyên tử lưu huỳnh trung hòa về điện
Phương pháp giải:
- Trong nguyên tử, số electron = số proton
- Chứng minh tổng điện tích trong nguyên tử lưu huỳnh bằng 0
Trả lời:
- Vì trong nguyên tử, số electron = số proton
=> Số proton trong nguyên tử lưu huỳnh = 16
- Xét nguyên tử lưu huỳnh, ta có:
+ 16 proton, mỗi proton có điện tích +1 => Tổng số điện tích: +12
+ Neutron không mang điện => Tổng số điện tích: 0
+ 16 eletron, mỗi electronn có điện tích -1 => Tổng số điện tích: -12
=> Tổng điện tích của nguyên tử lưu huỳnh = (+12) + 0 + (-12) = 0
=> Nguyên tử lưu huỳnh trung hòa về điện
3. Sự chuyển động của electron trong nguyên tử
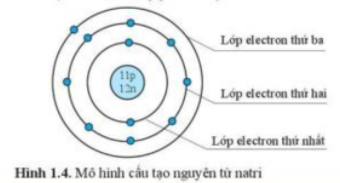
Phương pháp giải:
- Quan sát hình 1.4 và trả lời câu hỏi
+ Mỗi vòng tròn là 1 lớp electron
+ Mỗi chấm xanh là 1 electron
Trả lời:
- Trong hình 1.4 có
+ 3 vòng tròn => Natri có 3 lớp electron
+ 11 chấm xanh => Natri có 11 electron
Phương pháp giải:
- Các electron được xếp lần lượt vào các lớp theo chiều từ gần hạt nhân ra ngoài
- Lớp thứ nhất có tối đa 2 electron
- Lớp thứ 2 có tối đa 8 electon
Trả lời:
- Xét nguyên tử nito có 7 electron: được phân bố thành 2 lớp electron, lớp thứ nhất có 2 electron, lớp thứ 2 có 5 electron
=> Ta nói nguyên tử nito có 5 electron ở lớp ngoài cùng
- Xét nguyên tử silicon có 14 electron được phân bố thành 3 lớp electron, lớp thứ nhất có 2 electron, lớp thứ 2 có 8 electron, lớp thứ 3 có 4 electron
=> Ta nói nguyên tử silicon có 4 electron ở lớp ngoài cùng
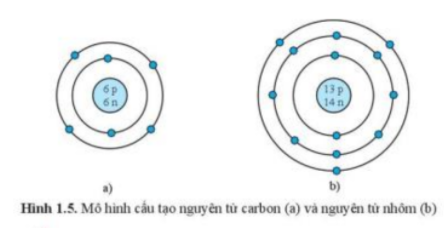
Phương pháp giải:
- Quan sát hình 1.5 và trả lời câu hỏi
+ Mỗi vòng tròn là 1 lớp electron
+ Mỗi chấm xanh là 1 electron
Trả lời:
- Xét hình 1.5a (nguyên tử carbon) ta có:
+ Có 2 vòng tròn => Nguyên tử carbon có 2 lớp electron
+ Vòng tròn thứ nhất có 2 chấm xanh => Lớp thứ nhất có 2 electron
+ Vòng tròn thứ 2 có 4 chấm xanh => Lớp thứ 2 có 4 electron
- Xét hình 1.5b (nguyên tử nhôm) ta có:
+ Có 3 vòng tròn => Nguyên tử nhôm có 3 lớp electron
+ Vòng tròn thứ nhất có 2 chấm xanh => Lớp thứ nhất có 2 electron
+ Vòng tròn thứ 2 có 8 chấm xanh => Lớp thứ 2 có 8 electron
+ Vòng tròn thứ 3 có 3 chấm xanh => Lớp thứ 3 có 3 electron
4. Khối lượng nguyên tử
Câu hỏi 5 trang 13 KHTN lớp 7: Trong ba loại hạt tạo nên nguyên tử, hạt nào có khối lượng nhỏ nhất?
Phương pháp giải:
- Proton và neutron đều có khối lượng xấp xỉ bằng 1 amu
- Electron có khối lượng là 0,00055 amu
Trả lời:
- Proton và neutron đều có khối lượng xấp xỉ bằng 1 amu
- Electron có khối lượng là 0,00055 amu
=> Hạt electron có khối lượng nhỏ nhất
Câu hỏi 6 trang 13 KHTN lớp 7: Khối lượng của nguyên tử được tính bằng đơn vị nào?
Phương pháp giải:
amu
Trả lời:
Khối lượng của nguyên tử được tính bằng đơn vị amu
Luyện tập 6 trang 13 KHTN lớp 7: Quan sát hình 1.5, hãy cho biết:
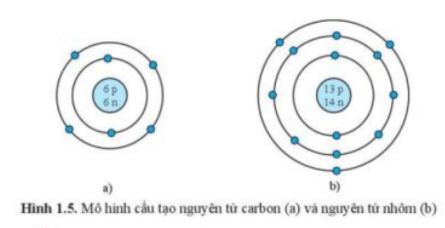
a) Số proton, neutron, electron trong mỗi nguyên tử carbon và nhôm
b) Khối lượng nguyên tử của carbon và nhôm
Phương pháp giải:
a) Trong nguyên tử số electron = số proton
b) Có thể coi khối lượng nguyên tử = khối lượng hạt nhân
- Mà hạt nhân gồm: proton và neutron đều có khối lượng xấp xỉ bằng 1amu.
Trả lời:
a)
- Xét hình 1.5a (nguyên tử carbon) ta có:
+ 6p => Nguyên tử carbon có 6 proton và 6 electron
+ 6n => Nguyên tử carbon có 6 neutron
- Xét hình 1.5b (nguyên tử nhôm) ta có:
+ 13p => Nguyên tử carbon có 13 proton và 13 electron
+ 14n => Nguyên tử carbon có 14 neutron
b)
- Khối lượng nguyên tử có thể coi = khối lượng hạt nhân
- Hạt nhân gồm: proton và neutron
=> Khối lượng nguyên tử = số proton.1 + số neutron.1
- Xét hình 1.5a (nguyên tử carbon) có 6 proton và 6 neutron
=> Khối lượng nguyên tử carbon = 6.1 + 6.1 = 12 amu
- Xét hình 1.5b (nguyên tử nhôm) có 13 proton và 14 neutron
=> Khối lượng nguyên tử nhôm = 13.1 + 14.1 = 27 amu
Luyện tập 7 trang 14 KHTN lớp 7: Hoàn thành thông tin còn thiếu theo bảng sau:
| Hạt trong nguyên tử | Khối lượng (amu) | Điện tích | Vị trí trong nguyên tử |
| Proton | ? | +1 | ? |
| Neutron | ? | ? | Hạt nhân |
| Electron | 0,00055 | ? | ? |
Phương pháp giải:
Nguyên tử bao gồm hạt nhân nguyên tử và vỏ nguyên tử
- Vỏ nguyên tử: tạo bởi electron mang điện tích âm, khối lượng = 0,00055 amu
- Hạt nhân nguyên tử:
+ Proton mang điện tích dương, khối lượng xấp xỉ bằng 1 amu
+ Neutron không mang điện, khối lượng xấp xỉ bằng 1 amu
Trả lời:
| Hạt trong nguyên tử | Khối lượng (amu) | Điện tích | Vị trí trong nguyên tử |
| Proton | 1 | +1 | Hạt nhân |
| Neutron | 1 | 0 | Hạt nhân |
| Electron | 0,00055 | -1 | Vỏ |
a) Hãy ghi chú thích tên các hạt tương ứng trong hình vẽ mô tả cấu tạo nguyên tử carbon
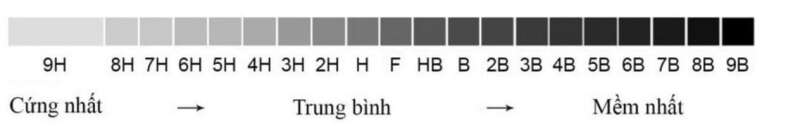
b) Em hãy tìm hiểu ý nghĩa của các kí hiệu HB, 2B và 6B được ghi trên một số loại bút chì.
Phương pháp giải:
a)
Tham khảo hình 1.2
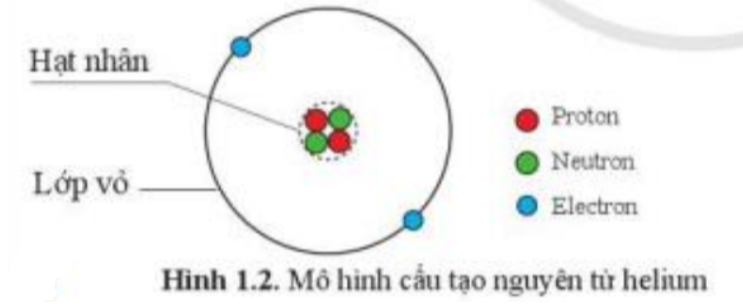
b)
Tham khảo tài liệu trong sách, báo, internet…
Trả lời:
a) Trong hình vẽ mô tả cấu tạo nguyên tử carbon:
- Quả cầu màu đỏ: Proton
- Quả cầu màu xanh lá cây: Neutron
- Quả cầu màu xanh da trời: Electron
b) “B” là loại bút chì mềm, “H” là loại bút chì rắn
Lý thuyết KHTN 7 Bài 1: Nguyên tử
I. Nguyên tử là gì?
Nguyên tử là những hạt cực kì nhỏ bé, không mang điện, cấu tạo nên chất.
Ví dụ:
- Kim cương, than chì đều được cấu tạo từ các nguyên tử carbon.

- Nước được tạo nên từ các nguyên tử hydrogen và oxygen.

II. Cấu tạo nguyên tử
Nguyên tử được coi như một quả cầu, gồm hạt nhân nguyên tử và vỏ nguyên tử.
1. Vỏ nguyên tử
- Vỏ nguyên tử được tạo bởi một hay nhiểu electron chuyển động xung quanh hạt nhân.
- Electron: kí hiệu: e; mỗi hạt electron mang điện tích -1.
2. Hạt nhân nguyên tử
- Vị trí: nằm ở tâm của nguyên tử.
- Kích thước: rất nhỏ so với nguyên tử.
- Thành phần: gồm proton và neutron.
+ Proton: kí hiệu: p; mỗi proton mang điện tích +1.
+ Neutron: kí hiệu: n; không mang điện.
- Điện tích hạt nhân nguyên tử = tổng điện tích các proton.
- Số đơn vị điện tích hạt nhân = số proton.
Ví dụ: Nguyên tử helium gồm hạt nhân có 2 proton, 2 neutron và vỏ nguyên tử có 2 electron.
Điện tích hạt nhân = tổng điện tích các proton = 2.(+1) = +2
Số đơn vị điện tích hạt nhân = số proton = 2
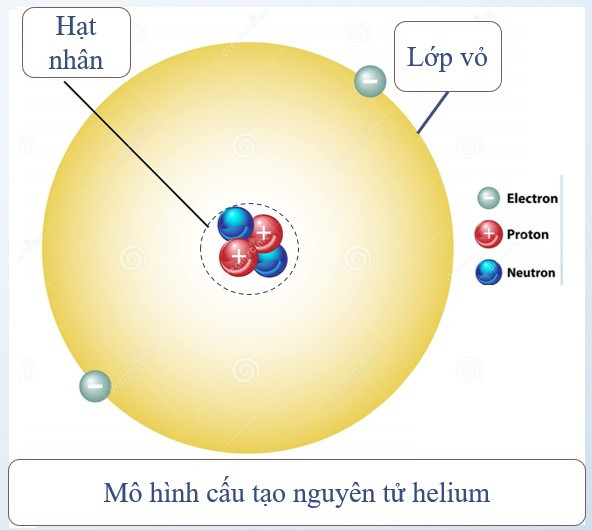
Chú ý:
Số proton = số electron ⇒ Nguyên tử trung hòa về điện
III. Sự chuyển động của electron trong nguyên tử
- Mô hình nguyên tử của Rơ-dơ-pho – Bo:
+ Electron chuyển động trên những quỹ đạo xác định xung quanh hạt nhân.
+ Electron phân bố trên các lớp electron theo chiều từ gần hạt nhân ra ngoài.
+ Số electron tối đa trên mỗi lớp được xác định, như lớp thứ nhất có tối đa 2 electron, lớp thứ hai có tối đa 8 electron,…
Ví dụ 1: Nguyên tử carbon có 6 electron, được phân bố thành hai lớp:
+ Lớp thứ nhất (lớp gần hạt nhân nhất) có 2 electron.
+ Lớp thứ hai có 4 electron.
Ta nói carbon có 4 electron ở lớp ngoài cùng.
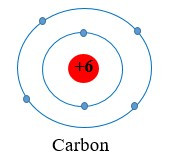
Mở rộng: Trong số các nguyên tử đã biết hiện nay, nguyên tử có kích thước lớn nhất là francium, có chứa 7 lớp electron. Nguyên tử helium có kích thước nhỏ nhất với 1 lớp electron.
IV. Khối lượng của nguyên tử
- Nguyên tử có khối lượng rất nhỏ. Một gam của bất kì chất nào cũng chứa tới hàng tỉ tỉ nguyên tử.
- Đơn vị đo khối lượng nguyên tử: amu (atomic mass unit)
1 amu = 1,6605. 10-24 g.
- Khối lượng của một nguyên tử = khối lượng của proton + khối lượng của neutron + khối lượng của electron.
Tuy nhiên, do khối lượng của electron (0,00055 amu) rất nhỏ so với khối lượng của proton (1 amu) hay neutron (1 amu).
Nên có thể coi khối lượng của một nguyên tử bằng khối lượng hạt nhân (hay bằng tổng khối lượng của proton và neutron).
Ví dụ:
- Nguyên tử sulfur có 16 proton và 16 neutron, nên khối lượng của một nguyên tử sulfur là: 16.1 + 16.1 = 32 (amu)
Xem thêm các bài giải SGK Khoa học tự nhiên lớp 7 Cánh diều hay, chi tiết khác:
Bài mở đầu : Phương pháp và kĩ năng trong học tập môn Khoa học tự nhiên
Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học