Với giải Bài 13.6 trang 34 SBT Hóa học lớp 10 Kết nối tri thức chi tiết trong Bài 13: Liên kết hydrogen và tương tác van der Waals giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 10. Mời các bạn đón xem:
Giải sách bài tập Hóa học lớp 10 Bài 13: Liên kết hydrogen và tương tác van der Waals
Bài 13.6 trang 34 SBT Hóa học 10: Cho các chất sau: F2, Cl2, Br2, I2
Chất có nhiệt độ nóng chảy thấp nhất là
A. F2
B. Cl2
C. Br2
D. I2
Lời giải
Đáp án đúng là: A
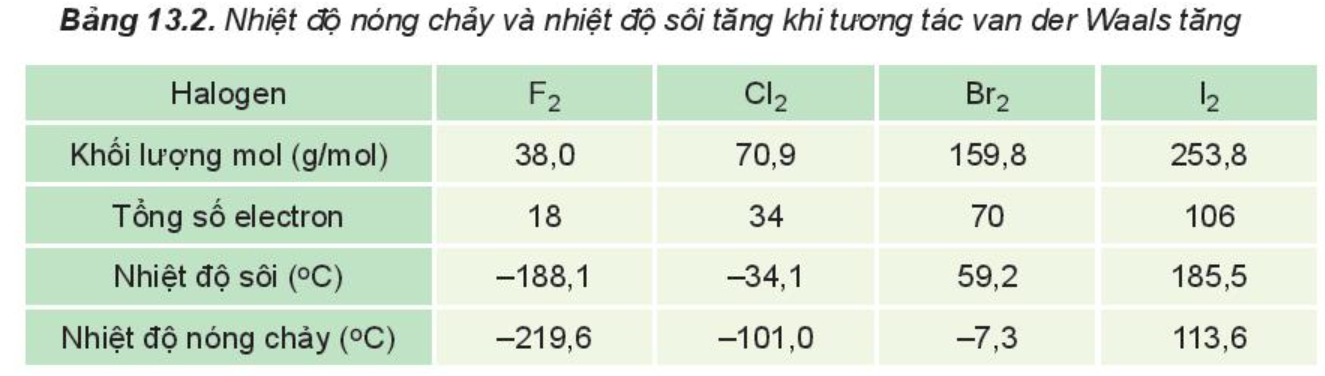
Trong dãy halogen, tương tác van der Waals tăng theo sự tăng số electron (và proton) trong phân tử, làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của các chất.
Số electron (và proton) trong phân tử tăng theo thứ tự: F2 < Cl2 < Br2 < I2
⇒ F2 có số electron (số proton) nhỏ nhất ⇒ Nhiệt độ nóng chảy thấp nhất.
Tương tác van der Waals
1. Khái niệm tương tác van der Waals
Tương tác van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử.
Ví dụ:
Các khí hiếm như neon, argon, … tồn tại dưới dạng các nguyên tử độc lập. Tuy nhiên ở nhiệt độ thấp, khí hiếm có thể hóa lỏng. Như vậy, ở nhiệt độ thấp, giữa các nguyên tử khí hiếm tồn tại một tương tác yếu để giữ các nguyên tử khí hiếm lại với nhau trong trạng thái lỏng. Tương tác đó cũng là tương tác van der Waals.
2. Ảnh hưởng của tương tác van der Waals đến nhiệt độ nóng chảy, nhiệt độ sôi của các chất
Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
Ví dụ 1: Trong dãy halogen, tương tác van der Waals tăng theo sự tăng của số electron (và proton) trong phân tử, làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của các chất.
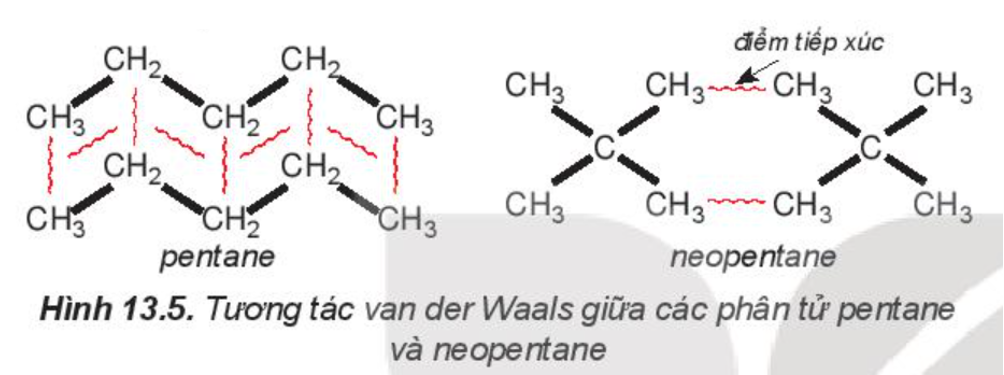
Ví dụ 2: Pentane là hydrocarbon no có công thức C5H12. Đồng phân mạch không phân nhánh pentane có nhiệt độ sôi (36oC) cao hơn so với đồng phân mạch nhánh neopentane (9,5oC) do diện tích tiếp xúc giữa các phân tử pentane lớn hơn nhiều so với neopentane.
Xem thêm các bài giải SBT Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 13.1 trang 34 SBT Hóa học 10: Liên kết hydrogen là loại liên kết hóa học được hình thành giữa các nguyên tử nào sau đây?
Bài 13.2 trang 34 SBT Hóa học 10: Tương tác van der Waals được hình thành do
Bài 13.3 trang 34 SBT Hóa học 10: Chất nào sau đây có thể tạo liên kết hydrogen?
Bài 13.4 trang 34 SBT Hóa học 10: Chất nào sau đây không thể tạo được liên kết hydrogen?
Bài 13.5 trang 34 SBT Hóa học 10: Tương tác van der Waals tồn tại giữa những
Bài 13.6 trang 34 SBT Hóa học 10: Cho các chất sau: F2, Cl2, Br2, I2
Bài 13.7 trang 34 SBT Hóa học 10: Cho các chất sau: F2, Cl2, Br2, I2
Chất có nhiệt độ sôi cao nhất là
Bài 13.8 trang 34 SBT Hóa học 10: Dãy chất nào sau đây xếp theo thứ tự nhiệt độ sôi tăng dần?
Bài 13.9 trang 35 SBT Hóa học 10: Cho các khí hiếm sau: He, Ne, Ar, Kr, Xe
Khí hiếm có nhiệt độ nóng chảy thấp nhất và cao nhất lần lượt là
Bài 13.10 trang 35 SBT Hóa học 10: Cho các chất sau: C2H6, H2O, NH3, PF3, C2H5OH
Số chất tạo được liên kết hydrogen là
Bài 13.11 trang 35 SBT Hóa học 10: Giữa H2O và HF có thể tạo ra ít nhất bao nhiêu liên kết hydrogen?
Nhiệt độ sôi -88oC là của chất nào sau đây?
Bài 13.13 trang 35 SBT Hóa học 10: Cho các chất sau: C2H6; CH3OH; CH3COOH
Chất nào có thể tạo được liên kết hydrogen? Vì sao?
Bài 13.16 trang 35 SBT Hóa học 10: Trong phân tử nước và ammonia, phân tử nào có thể tạo nhiều liên kết hydrogen hơn? Vì sao?
Bài 13.18 trang 35 SBT Hóa học 10: Cho các chất và các trị số nhiệt độ sôi (oC) sau: H2O, H2S, H2Se, H2Te và -42; -2; 100; -61.
Xem thêm các bài giải SBT Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 13: Liên kết hydrogen và tương tác van der Waals