Với giải sách bài tập Hoá học 10 Bài 12: Liên kết cộng hóa trị sách Kết nối tri thức hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hoá học 10. Mời các bạn đón xem:
Giải SBT Hoá học lớp 10 Bài 12: Liên kết cộng hóa trị
Nhận biết
Bài 12.1 trang 32 SBT Hóa học 10: Liên kết cộng hóa trị là liên kết hóa học được hình thành giữa hai nguyên tử bằng
A. một electron chung
B. sự cho – nhận electron
C. một cặp electron góp chung.
D. một hay nhiều cặp electron dùng chung
Lời giải:
Đáp án đúng là: C
Liên kết cộng hóa trị là liên kết hóa học được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung
Ví dụ: Liên kết cộng hóa trị trong phân tử HCl

Bài 12.2 trang 32 SBT Hóa học 10: Hợp chất nào sau đây có liên kết cộng hóa trị không phân cực?
A. LiCl
B. CF2Cl2
C. CHCl3
D. N2
Lời giải:
Đáp án đúng là: D
Hiệu độ âm điện trong phân tử N2 bằng 0.
Bài 12.3 trang 32 SBT Hóa học 10: Hợp chất nào sau đây có liên kết cộng hóa trị phân cực?
A. H2
B. CHCl3
C. CH4
D. N2
Lời giải:
Đáp án đúng là: B
- H2 và N2 có hiệu độ âm điện bằng 0 ⇒ Có liên kết cộng hóa trị không phân cực.
- Hợp chất CHCl3 gồm 1 liên kết C-H và 3 liên kết C-Cl
Hợp chất CH4 gồm 4 liên kết C-H
(C-H) = |2,55 – 2,2| = 0,35 ⇒ Liên kết cộng hóa trị không phân cực
(C-Cl) = |2,55 – 3,16| = 0,61 ⇒ Liên kết cộng hóa trị phân cực.
Vậy hợp chất CHCl3 có liên kết cộng hóa trị không phân cực.
Bài 12.4 trang 32 SBT Hóa học 10: Liên kết σ là liên kết hình thành do
A. sự xen phủ bên của hai orbital
B. cặp electron dùng chung
C. lực hút tĩnh điện giữa hai ion
D. sự xen phủ trục của hai orbital.
Lời giải:
Đáp án đúng là: D
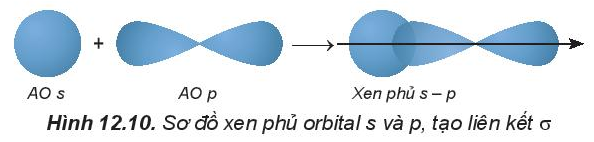
Liên kết σ là liên kết hình thành do sự xen phủ trục của hai orbital.
Ví dụ:
Bài 12.5 trang 32 SBT Hóa học 10: Liên kết π là liên kết hình thành do
A. sự xen phủ bên của hai orbital
B. cặp electron dùng chung
C. lực hút tĩnh điện giữa hai ion
D. sự xen phủ trục của hai orbital
Lời giải:
Đáp án đúng là: A
Liên kết π là liên kết hình thành do sự xen phủ bên của hai orbital
Bài 12.6 trang 32 SBT Hóa học 10: Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital p – p?
A. H2
B. Cl2
C. NH3
D. HCl
Lời giải:
Đáp án đúng là: B
H (Z = 1): 1s1
Cl (Z = 17): 1s22s22p63s23p5
N (Z = 7): 1s22s22p3
A. Liên kết trong phân tử H2 được hình thành nhờ sự xem phủ orbital s – s.
B. Liên kết trong phân tử Cl2 được hình thành bởi sự xen phủ orbital p – p.
C. Liên kết trong phân tử NH3 được hình thành bởi sự xen phủ orbital s – p.
D. Liên kết trong phân tử HCl được hình thành bởi sự xen phủ orbital s – p.
Bài 12.7 trang 32 SBT Hóa học 10: Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital s – s?
A. H2
B. Cl2
C. NH3
D. HCl
Lời giải:
Đáp án đúng là: A
H (Z = 1): 1s1
Cl (Z = 17): 1s22s22p63s23p5
N (Z = 7): 1s22s22p3
A. Liên kết trong phân tử H2 được hình thành nhờ sự xem phủ orbital s – s.
B. Liên kết trong phân tử Cl2 được hình thành bởi sự xen phủ orbital p – p.
C. Liên kết trong phân tử NH3 được hình thành bởi sự xen phủ orbital s – p.
D. Liên kết trong phân tử HCl được hình thành bởi sự xen phủ orbital s – p.
Bài 12.8 trang 32 SBT Hóa học 10: Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital s – p?
A. H2
B. Cl2
C. NH3
D. O2
Lời giải:
Đáp án đúng là: C
H (Z = 1): 1s1
Cl (Z = 17): 1s22s22p63s23p5
N (Z = 7): 1s22s22p3
O (Z = 8): 1s22s22p4
A. Liên kết trong phân tử H2 được hình thành nhờ sự xem phủ orbital s – s.
B. Liên kết trong phân tử Cl2 được hình thành bởi sự xen phủ orbital p – p.
C. Liên kết trong phân tử NH3 được hình thành bởi sự xen phủ orbital s – p.
D. Liên kết trong phân tử O2 được hình thành bởi sự xen phủ orbital p – p.
Thông hiểu
Bài 12.9 trang 32 SBT Hóa học 10: Các liên kết trong phân tử oxygen gồm
A. 2 liên kết π
B. 2 liên kết σ
C. 1 liên kết σ, 1 liên kết π
D. 1 liên kết σ
Lời giải:
Đáp án đúng là: C
Trong phân tử oxygen (O2) hai nguyên tử O liên kết với nhau bằng 1 liên kết đôi (O=O).
1 liên kết đôi gồm 1 liên kết σ, 1 liên kết π
Bài 12.10 trang 32 SBT Hóa học 10: Số liên kết σ và π có trong phân tử C2H2 lần lượt là
A. 2 và 3
B. 3 và 1
C. 2 và 2
D. 3 và 2
Lời giải:
Đáp án đúng là: D
Công thức cấu tạo của C2H2 là: H-C≡C-H
Liên kết 3 gồm 1 liên kết σ và 2 liên kết π.
⇒ Tổng số liên kết σ và π có trong phân tử C2H2 lần lượt là: 3 và 2
Bài 12.11 trang 33 SBT Hóa học 10: Dãy nào sau đây gồm các chất chỉ có liên kết cộng hóa trị?
A. BaCl2, NaCl, NO2
B. SO2, CO2, Na2O2
C. SO3, H2S, H2O
D. CaCl2, F2O, HCl
Lời giải:
Đáp án đúng là: C
A. BaCl2 và NaCl chứa liên kết ion.
B. Na2O2 chứa liên kết ion
D. CaCl2 chứa liên kết ion.
Bài 12.12 trang 33 SBT Hóa học 10: Cho hai nguyên tố X (Z = 20) và Y (Z = 17). Công thức hợp chất tạo thành từ nguyên tố X, Y và liên kết trong phân tử là
A. XY: liên kết cộng hóa trị
B. X2Y3: liên kết cộng hóa trị
C. X2Y: liên lết ion
D. XY2: liên kết ion
Lời giải:
Đáp án đúng là: D
X (Z = 20): 1s22s22p63s23p64s2
Y (Z = 17): 1s22s22p63s23p5
Nguyên tử X là kim loại mạnh, có xu hướng nhường đi 2 electron lớp ngoài cùng tạo thành cation X2+.
Nguyên tử Y là phi kim điển hình, có xu hướng nhận thêm 1 electron và lớp ngoài cùng tạo thành anion Y-.
Ion X2+ và Y- trái dấu hút nhau tạo thành phân tử XY2. Liên kết được tạo thành là liên kết ion.
X2+ + 2Y- → XY2
Lời giải:
Tuy có độ âm điện của chlorine và nitrogen gần bằng nhau nhưng do trong phân tử Cl2 có liên kết đơn σ (Cl-Cl) còn trong phân tử N2 có liên kết ba (N≡N) gồm 1 liên kết σ và 2 liên kết π rất bền vững. Năng lượng cần để phá vỡ liên kết ba trong phân tử N2 lớn hơn nhiều so với năng lượng cần để phá vỡ một liên kết đơn trong phân tử Cl2. Do đó, ở điều kiện thường, N2 hoạt động kém Cl2.
Vận dụng
Bài 12.14 trang 33 SBT Hóa học 10: Cho các phân tử sau: F2, N2, H2O, CO2.
a) Hãy viết công thức Lewis của các phân tử đó.
b) Hãy cho biết phân tử nào chứa liên kết cộng hóa trị phân cực và phân tử nào chứa liên kết cộng hóa trị không phân cực; phân tử nào phân cực và phân tử nào không phân cực?
Lời giải:
a) Công thức Lewis của các phân tử:
F2
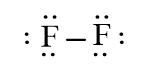
N2
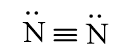
H2O
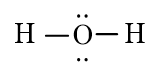
CO2
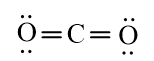
b) Phân tử chứa liên kết cộng hóa trị không phân cực: N2, F2.
Phân tử chứa liên kết cộng hóa trị phân cực: H2O, CO2.
Phân tử phân cực: H2O.
Phân tử không phân cực: N2, F2, CO2.
Bài 12.15 trang 33 SBT Hóa học 10: Cho các phân tử sau: Br2, H2S, CH4, NH3, C2H4, C2H2
a) Phân tử nào có liên kết cộng hóa trị không phân cực? Phân tử nào có liên kết cộng hóa trị phân cực?
b) Phân tử nào chỉ có liên kết đơn? Phân tử nào có liên kết đôi? Phân tử nào có liên kết ba?
Lời giải:
a) Phân tử có liên kết cộng hóa trị không phân cực: Br2.
Phân tử có liên kết cộng hóa trị phân cực: H2S, CH4, NH3, C2H4 và C2H2.
b) Phân tử chỉ có liên kết đơn: H2S, CH4, NH3 và Br2.
Phân tử có liên kết đôi: CH2=CH2.
Phân tử có liên kết ba: CH≡CH.
Bài 12.16 trang 33 SBT Hóa học 10: Ghép nhiệt độ nóng chảy với chất tương ứng và giải thích
|
Chất |
Nhiệt độ nóng chảy (oC) |
|
a) Nước |
1) -138 |
|
b) Muối ăn |
2) 80 |
|
c) Băng phiến |
3) 0 |
|
d) Butane |
4) 801 |
Lời giải:
a) - 3);
b) – 4);
c) – 2);
d) – 1).
Nước, băng phiến, butane là các hợp chất cộng hóa trị, phân tử có độ phân cực không cao nên dễ tách ra khỏi nhau khi đun nóng. Ngược lại, NaCl là tinh thể ion có lực hút mạnh giữa các ion nên khó tách ra khỏi nhau và có nhiệt độ nóng chảy cao.
Xem thêm các bài giải SBT Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 13: Liên kết hydrogen và tương tác van der Waals
Bài 15: Phản ứng oxi hóa - khử
Lý thuyết Liên kết cộng hóa trị
I. Sự tạo thành liên kết cộng hóa trị
Nguyên tử phi kim có xu hướng nhận thêm electron để đạt cấu hình electron bền vững của khí hiếm.
Khi hai nguyên tử phi kim kết hợp với nhau tạo thành phân tử, chúng sẽ góp chung một hoặc nhiều electron để tạo thành các cặp electron dùng chung. Các cặp electron dùng chung được tính cho cả hai nguyên tử trong phân tử nên mỗi nguyên tử đều đạt cấu hình bền vững theo quy tắc octet. Cặp electron dùng chung tạo ra liên kết cộng hóa trị giữa hai nguyên tử.
Cặp electron dùng chung giữa hai nguyên tử có thể được tạo thành theo hai kiểu khác nhau:
- Mỗi nguyên tử góp một hay nhiều electron để tạo thành các cặp electron dùng chung:
Ví dụ:
A× + ×B A : B hoặc A – B (liên kết A – B là liên kết cộng hóa trị).
- Cặp electron dùng chung chỉ do một nguyên tử đóng góp, liên kết giữa hai nguyên tử là liên kết cộng hóa trị kiểu cho – nhận.
Ví dụ:
Khi cặp electron dùng chung chỉ do nguyên tử B đóng góp, nguyên tử B là nguyên tử cho electron, nguyên tử A là nguyên tử nhận electron. Kí hiệu B A.
1. Sự tạo thành phân tử có liên kết đơn
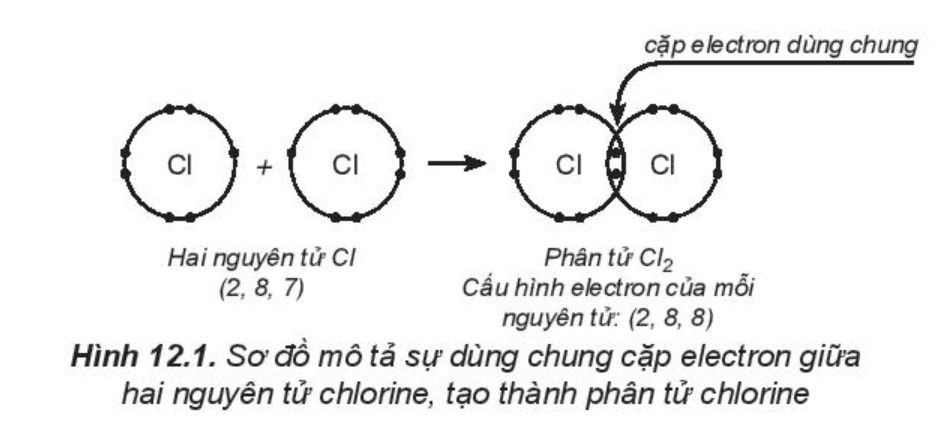
- Phân tử chlorine (Cl2):
Cấu hình electron của nguyên tử Cl (Z = 17): [Ne]3s23p5 (có 7 electron hóa trị).
Hai nguyên tử chlorine liên kết với nhau bằng cách mỗi nguyên tử chlorine góp 1 electron, tạo thành 1 cặp electron dùng chung. Khi đó, trong phân tử Cl2, mỗi nguyên tử đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet:
Từ công thức electron, thay một cặp electron dùng chung bằng một gạch nối thì thu được công thức Lewis (Li-uýt):
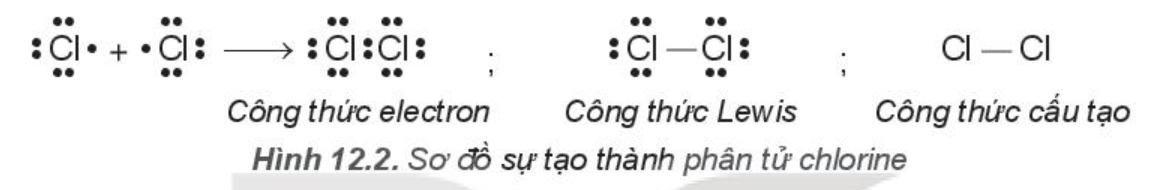
Giữa hai nguyên tử chlorine có một cặp electron dùng chung (biểu diễn bằng một gạch nối), đó là liên kết đơn.
- Phân tử hydrogen chloride (HCl):
Nguyên tử hydrogen liên kết với nguyên tử chlorine bằng cách mỗi nguyên tử góp 1 electron tạo thành 1 cặp electron dùng chung trong phân tử HCl. Khi đó nguyên tử hydrogen có 2 electron (cấu hình bền vững của nguyên tử khí hiếm helium) và nguyên tử chlorine có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.

Giữa hai nguyên tử hydrogen và chlorine có một cặp electron dùng chung (biểu diễn bằng 1 gạch nối), đó là liên kết đơn.
- Phân tử hợp chất có liên kết cho – nhận:
Trong phân tử NH3, lớp ngoài cùng của nguyên tử nitrogen có 5 electron, trong đó có cặp electron chưa liên kết. Ion H+ có orbital trống, không có electron. Khi phân tử NH3 kết hợp với ion H+, nguyên tử nitrogen đóng góp cặp electron chưa liên kết để tạo liên kết với ion H+ tạo thành . Khi đó, liên kết cho – nhận được hình thành, nguyên tử nitrogen là nguyên tử cho, ion H+ là nguyên tử nhận. Trong ion , bốn liên kết N – H hoàn toàn tương đương nhau.
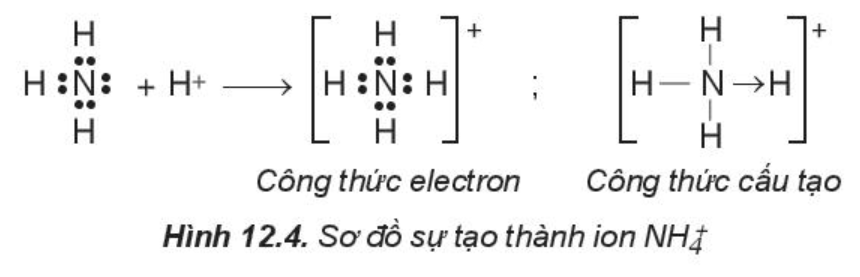 2. Sự tạo thành phân tử có liên kết đôi
2. Sự tạo thành phân tử có liên kết đôi
- Phân tử oxygen (O2):
Mỗi nguyên tử oxygen có 6 electron hóa trị, hai nguyên tử oxygen liên kết với nhau bằng cách mỗi nguyên tử đóng góp 2 electron, tạo thành 2 cặp electron dùng chung. Trong phân tử O2, mỗi nguyên tử oxygen đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.

Giữa hai nguyên tử oxygen có hai cặp electron dùng chung (biểu diễn bằng hai gạch nối), đó là liên kết đôi.
- Phân tử carbon dioxide (CO2):
Nguyên tử carbon có 4 electron hóa trị, nguyên tử oxygen có 6 electron hóa trị. Hai nguyên tử oxygen liên kết với một nguyên tử carbon bằng cách mỗi nguyên tử oxygen đóng góp 2 electron và nguyên tử carbon đóng góp 4 electron tạo thành 4 cặp electron dùng chung. Khi đó, trong phân tử CO2, mỗi nguyên tử đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.
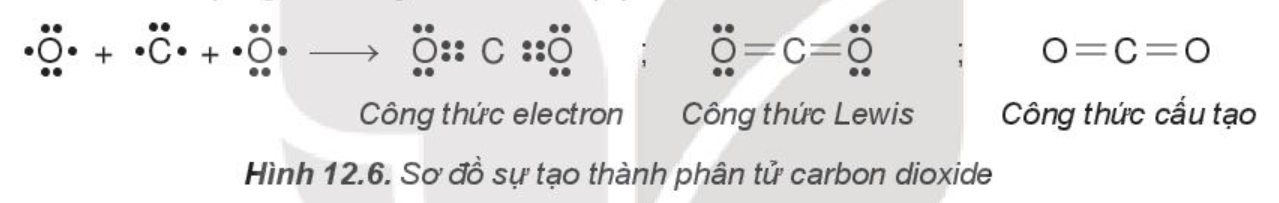 Phân tử CO2 có hai liên kết đôi.
Phân tử CO2 có hai liên kết đôi.
3. Sự tạo thành phân tử có liên kết ba
Phân tử nitrogen (N2):
Nguyên tử nitrogen có 5 electron hóa trị, hai nguyên tử nitrogen liên kết với nhau bằng cách mỗi nguyên tử nitrogen đóng góp 3 electron, tạo thành 3 cặp electron dùng chung. Khi đó, trong phân tử N2, mỗi nguyên tử đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.

Giữa hai nguyên tử nitrogen có ba cặp electron dùng chung (biểu diễn bằng ba gạch nối), đó là liên kết ba.
Kết luận:
- Liên kết cộng hóa trị là liên kết được tạo thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.
- Liên kết trong các phân tử Cl2, O2, N2, … có cặp electron dùng chung không bị hút lệch về phía nguyên tử nào được gọi là liên kết cộng hóa trị không phân cực.
- Liên kết trong phân tử HCl có cặp electron dùng chung lệch về phía nguyên tử có độ âm điện lớn hơn (Cl) được gọi là liên kết cộng hóa trị phân cực.
II. Độ âm điện và liên kết hóa học
Dựa vào sự khác nhau về độ âm điện giữa các nguyên tử tham gia liên kết, có thể dự đoán được loại liên kết giữa hai nguyên tử đó.

Ví dụ:
- Trong phân tử HCl, hiệu độ âm điện của Cl và H: 3,16 – 2,20 = 0,96.
Liên kết giữa H và Cl là liên kết cộng hóa trị phân cực.
- Trong phân tử CO2, hiệu độ âm điện của O và C: 3,44 – 2,55 = 0,89.
Liên kết giữa C và O là liên kết cộng hóa trị phân cực. Tuy nhiên, do phân tử CO2 có cấu tạo thẳng nên độ phân cực của hai liên kết đôi (C=O) triệt tiêu nhau, dẫn đến toàn bộ phân tử không bị phân cực.
- Trong phân tử NaCl, hiệu độ âm điện của Cl và Na: 3,16 – 0,93 = 2,23.
Liên kết giữa Na và Cl là liên kết ion.
Chú ý:
Liên kết cộng hóa trị phân cực có thể được coi là dạng trung gian giữa liên kết công hóa trị không phân cực và liên kết ion.
III. Mô tả liên kết cộng hóa trị bằng sự xen phủ các orbital nguyên tử
1. Sự xen phủ các orbital nguyên tử tạo liên kết s (sigma)
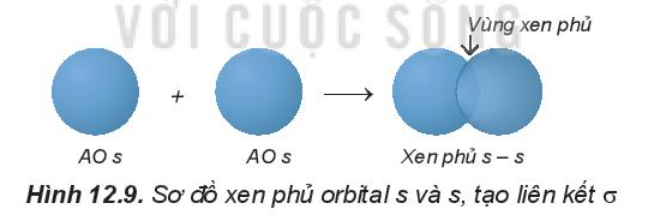
- Sự xen phủ s – s:
Phân tử H2 tạo thành từ hai nguyên tử H (1s1). Khi 2 nguyên tử H tiến lại gần nhau, hạt nhân của nguyên tử này hút đám mây electron của nguyên tử kia, hai orbital nguyên tử xen phủ vào nhau một phần. Vùng xen phủ có mật độ điện tích âm lớn, làm tăng lực hút của mỗi hạt nhân với vùng này và làm cân bằng lực đẩy giữa hai hạt nhân, để hai nguyên tử liên kết với nhau.
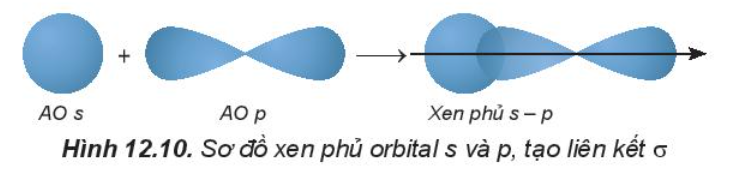
- Sự xen phủ s – p:
Phân tử HF tạo thành khi orbital 1s của nguyên tử H (1s1) xen phủ với orbital 2p của nguyên tử F (2s22p5) theo trục liên kết, tạo liên kết cộng hóa trị giữa H và F, vùng xen phủ càng lớn thì liên kết càng bền.
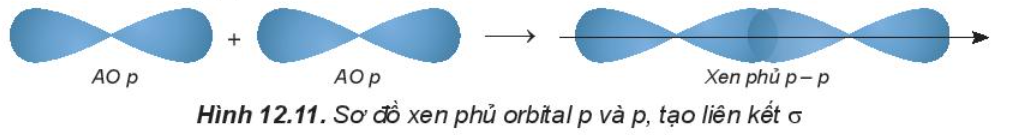
 - Sự xen phủ p – p:
- Sự xen phủ p – p:
Phân tử Cl2 tạo thành khi hai orbital 3p của hai nguyên tử Cl (3s23p5) xen phủ theo trục liên kết của hai nguyên tử Cl.
 Nhận xét:
Nhận xét:
Các liên kết cộng hóa trị đơn đều là liên kết s. Trong liên kết s, mật độ xác suất tìm thấy electron lớn nhất dọc theo trục liên kết.
2. Sự xen phủ các orbital nguyên tử tạo liên kết p (pi)
Sự xen phủ, trong đó trục của các orbital tham gia liên kết song song với nhau và vuông góc với đường nối tâm của hai nguyên tử liên kết, được gọi là xen phủ bên. Sự xen phủ bên tạo ra liên kết p (pi).
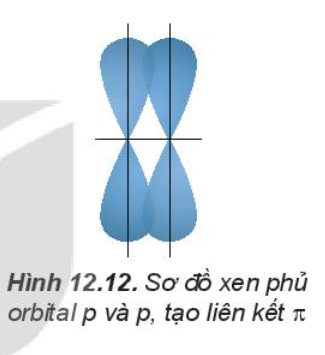 Liên kết đôi gồm một liên kết s và một liên kết p. Liên kết ba gồm một liên kết s và hai liên kết p.
Liên kết đôi gồm một liên kết s và một liên kết p. Liên kết ba gồm một liên kết s và hai liên kết p.
IV. Năng lượng liên kết cộng hóa trị
Năng lượng liên kết (Eb) là năng lượng cần thiết để phá vỡ một liên kết hóa học trong phân tử ở thể khí thành các nguyên tử ở thể khí. Năng lượng liên kết thường có đơn vị là kJ/mol.
Ví dụ: Để phá vỡ 1 mol liên kết H–Cl thành các nguyên tử H và Cl (ở thể khí) theo phương trình:
HCl(g) H(g) + Cl(g)
cần năng lượng là 432 kJ, nên năng lượng liên kết H–Cl là Eb = 432 kJ/mol.
Năng lượng liên kết đặc trưng cho độ bền của liên kết. Năng lượng liên kết càng lớn thì liên kết càng bền và phân tử càng khó bị phân hủy.