Với giải Câu 2 trang 44 Hóa học lớp 10 Kết nối tri thức với cuộc sống chi tiết trong Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học.
Câu 2 trang 44 Hóa học 10: Nguyên tố magnesium thuộc ô số 12, chu kì 3, nhóm IIA của bảng tuần hoàn.
a) Viết cấu hình electron của magnesium, nếu một số tính chất cơ bản của đơn chất và oxide, hydroxide chứa magnesium.
b) So sánh tính kim loại của magnesium với các nguyên tố lân cận trong bảng tuần hoàn.
Phương pháp giải:
- Vị trí ô của nguyên tố => số electron và so sánh được tính chất với các nguyên tố lân cận.
- Thứ tự của chu kì => số lớp electron của nguyên tử đó.
- Thứ tự nhóm => số electron lớp ngoài cùng => dự đoán tính chất cơ bản của đơn chất, oxide và hydroxide
- Trong một chu kì, tính kim loại giảm dần theo chiều tăng của điện tích hạt nhân.
- Trong một nhóm, tính kim loại tăng dần theo chiều tăng của điện tích hạt nhân.
Lời giải:
a) Cấu hình electron của magnesium: 1s22s22p63s2
- Mg nằm ở nhóm IIA, là nguyên tố s nên Mg là kim loại
- MgO và Mg(OH)2 là oxide và hydroxide của kim loại Mg (nằm ngay đầu chu kì) nên hoạt động hóa học tương đối mạnh so với các hợp chất tạo bởi nguyên tố lân cận trong cùng một chu kì.
b)
Tính kim loại giảm dần theo thứ tự Na > Mg > Al.
Tính kim loại tăng dần theo thứ tự Be < Mg < Ca.
Lý thuyết Ý nghĩa của bảng tuần hoàn
Vị trí của nguyên tố trong bảng tuần hoàn các nguyên tố hóa học cho biết cấu hình electron nguyên tử, từ đó dự đoán được tính chất hóa học của các nguyên tố.
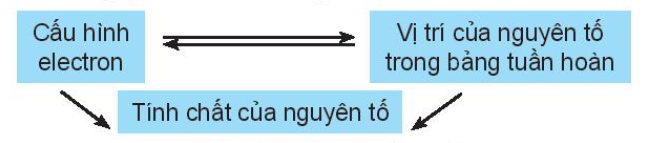
Chú ý: Từ vị trí của nguyên tố trong bảng tuần hoàn, có thể:
- Viết được cấu hình electron của nguyên tử và ngược lại.
- Dự đoán được tính chất (tính kim loại, tính phi kim) của nguyên tố đó.
- Viết được công thức oxide, hydroxide và nêu tính acid, base tương ứng.
Ví dụ 1: Nguyên tố chlorine (Cl) ở ô số 17, nhóm VIIA, chu kì 3.
- Nguyên tử Cl có:
+ 17 proton, 17 electron (do số proton = số electron = Z).
+ 3 lớp electron (do số lớp electron = số thứ tự chu kì).
+ 6 electron lớp ngoài cùng (do số electron lớp ngoài cùng = số thứ tự nhóm A).
Cấu hình electron của Cl: 1s22s22p63s23p5. Cl là nguyên tố phi kim. Oxide cao nhất (Cl2O7) là acidic oxide và acid tương ứng HClO4 là acid mạnh.
Ví dụ 2: Cấu hình electron của nguyên tử phosphorus (P) là 1s22s22p63s23p3.
- Nguyên tử P có Z = 15 (do số proton = số electron = Z).
- Nguyên tố P ở chu kì 3, nhóm VA (do có 3 lớp electron và có 5 electron ở lớp ngoài cùng).
- P là nguyên tố phi kim. Oxide cao nhất (P2O5) là acidic oxide và acid tương ứng là (HPO3 hay H3PO4) là acid trung bình.
Ví dụ 3: So sánh tính phi kim của P (Z = 15), O (Z = 8) và S (Z = 16).
P (Z = 15): 1s22s22p63s23p3 Nguyên tố P thuộc chu kì 3, nhóm VA.
O (Z = 8): 1s22s22p4 Nguyên tố O thuộc chu kì 2, nhóm VIA.
S (Z = 16): 1s22s22p63s23p4 Nguyên tố S thuộc chu kì 3, nhóm VIA.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần Tính phi kim: P < S.
Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần Tính phi kim: S < O.
Vậy tính phi kim: P < S < O.
Xem thêm các bài giải Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Xem thêm các bài giải SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học